

2025-11-12
模型相关
狼疮肾炎(LN)是系统性红斑狼疮(SLE)致终末期肾病(ESRD)的关键原因,炎症与纤维化进展加剧肾功能恶化。虽已知免疫细胞及细胞因子的作用,且有相关靶向制剂,但由于对肾脏局部 “促损伤微环境” 缺乏系统解析,单一靶向治疗(如 IL-17 拮抗剂)的疗效有限。
近期,澎立生物作为参与单位,在国际免疫学权威期刊《Frontiers in Immunology》(IF=8.7)在线发表了题为“Enhancing the treatment potential of IL-17 antagonism in lupus nephritis: finding the right partner”的综述论文。该研究深入剖析LN发病机制,不仅揭示 IL-17 与 IL-36 的 “协同促损伤轴”,更通过三大动物模型实验验证双靶点阻断的有效性,为 LN 治疗提供新方案。
系统性红斑狼疮(SLE)是一种累及多器官的复杂自身免疫病,其中40%-70%患者会并发狼疮肾炎(LN),4%-28%的LN患者最终进展为终末期肾病(ESRD),严重威胁生命健康。当前LN治疗以B细胞靶向药物(如利妥昔单抗、贝利尤单抗)和非特异性免疫抑制剂为主,但存在两大局限:
1. 疗效有限:现有生物制剂仅能实现“中等程度”临床获益,部分患者对治疗无响应;
2. 副作用显著:长期使用糖皮质激素、环磷酰胺等药物,易引发感染、性腺损伤、骨质疏松等严重不良反应。
IL-17作为重要的促炎细胞因子,在LN发病中扮演关键角色——可促进肾足细胞损伤、系膜细胞炎症反应及肾小管纤维化。此前IL-17拮抗剂(如司库奇尤单抗)在银屑病等疾病中疗效显著,但针对LN的III期临床试验(如SELUNE研究)却因疗效不足提前终止,单一靶点阻断难以突破治疗瓶颈。
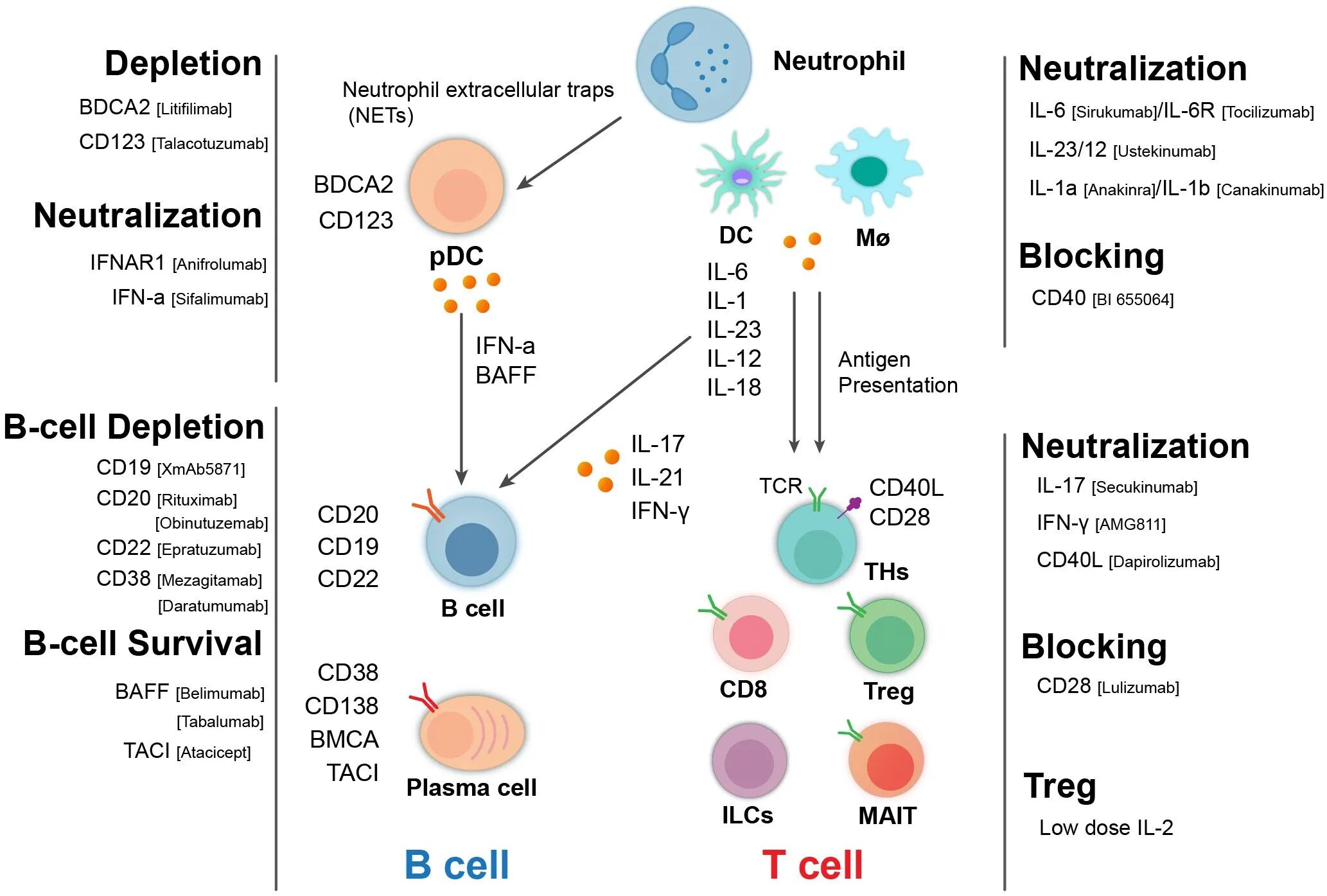
图1. LN相关的免疫细胞和分子及治疗靶标
DOI 10.3389/fimmu.2025.1617451
研究团队通过临床样本分析与动物模型验证,揭示了IL-17与IL-36家族的“协同致病机制”,为双靶点治疗提供了科学依据。
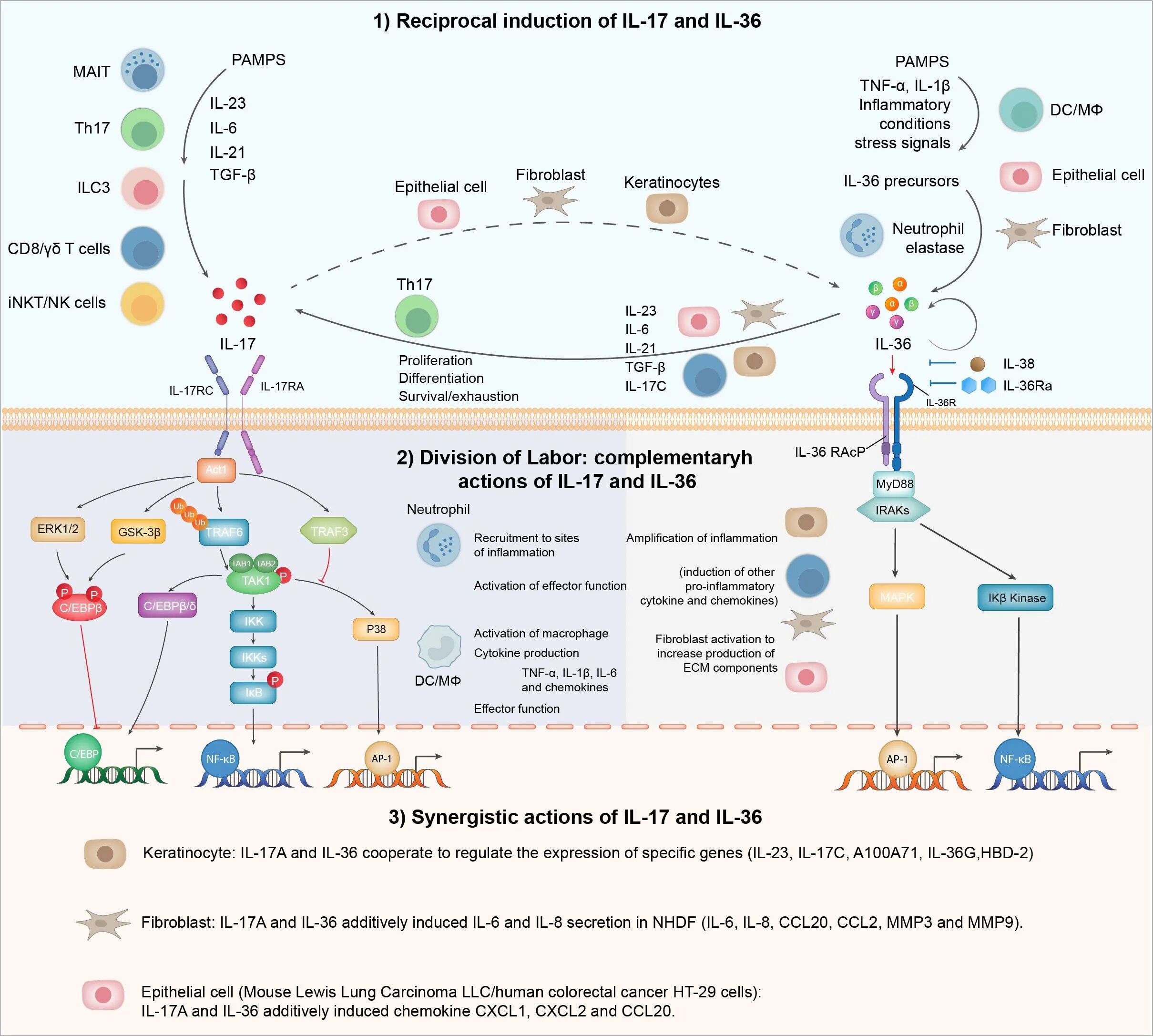
图2. IL-17和IL-36的协同致病机制
DOI 10.3389/fimmu.2025.1617451
为明确 IL-17 与 IL-36 的相互作用,团队通过狼疮易感小鼠、单侧输尿管梗阻(UUO)模型、抗肾小球基底膜肾炎模型,从不同维度验证两者的协同机制:
1. 狼疮易感小鼠(MRL/lpr):IL-36R 敲除缓解 LN 病理
将 IL-36 受体敲除(IL-36R⁻/⁻)的 MRL/lpr 小鼠与野生型小鼠对比,发现敲除组小鼠的肾小球系膜基质扩张面积减少 45%,肾小管间质炎症评分降低 38%;肾脏组织中 IL-17⁺Th17 细胞浸润减少 52%,且 TGF-β1、胶原 I 等纤维化标志物表达显著下调;
同时,血清抗 dsDNA 抗体水平下降 27%,补体 C3 水平回升,提示 IL-36 不仅影响局部炎症,还间接调控全身自身免疫反应。
2. UUO 模型:双阻断比单阻断更抗纤维化
UUO 模型是研究肾间质纤维化的经典模型。团队在此模型中设置 “对照组、抗 IL-17 单药组、抗 IL-36 单药组、双阻断组”,结果显示,双阻断组的肾间质胶原沉积面积仅为对照组的 32%,显著低于单药组(抗 IL-17 组为 58%,抗 IL-36 组为 63%);
双阻断可使肾脏巨噬细胞(F4/80⁺)浸润减少 67%,成纤维细胞活化标志物(α-SMA)表达下降 71%;机制上,双阻断能同时抑制 NF-κB 通路(减少促炎因子)与 TGF-β/Smad 通路(减少纤维化分子),而单药仅能抑制其中一条通路。
3. 抗肾小球基底膜肾炎模型:双阻断保护肾小球功能
在模拟 LN 肾小球损伤的模型中,双阻断组表现出更优的肾脏保护效果:小鼠尿蛋白 / 肌酐比值较对照组下降 62%,显著优于单药组(抗 IL-17 组下降 35%,抗 IL-36 组下降 31%);肾小球足细胞损伤标志物(Nephrin)表达量较单药组高 2.3 倍,提示双阻断可减少足细胞脱落,保护肾小球滤过功能;肾小球内中性粒细胞(Ly6G⁺)浸润减少 65%,避免中性粒细胞 extracellular traps(NETs)形成引发的二次损伤。
双靶点策略的 “落地路径”基于动物实验的阳性结果,团队提出 LN 双靶点治疗的两大转化方向:
联合用药:将现有 IL-17 拮抗剂(如司库奇尤单抗)与 IL-36R 拮抗剂(已在银屑病中获批)联合,针对难治性 LN 开展 II 期临床试验,重点观察尿蛋白、肾功能及肾脏炎症指标的变化;
双特异性抗体开发:设计可同时结合 IL-17 与 IL-36R 的双抗,通过 “局部富集” 特性,减少全身免疫抑制副作用,目前已在体外实验中验证其亲和力与特异性。
研究最后指出,未来需在人类 LN 肾穿刺样本中进一步验证 IL-17 与 IL-36 的共定位关系,并通过前瞻性临床研究明确双靶点治疗的最佳剂量与疗程,为 LN 患者提供更精准的治疗选择。
澎立生物可为狼疮肾炎提供专业药效研究服务
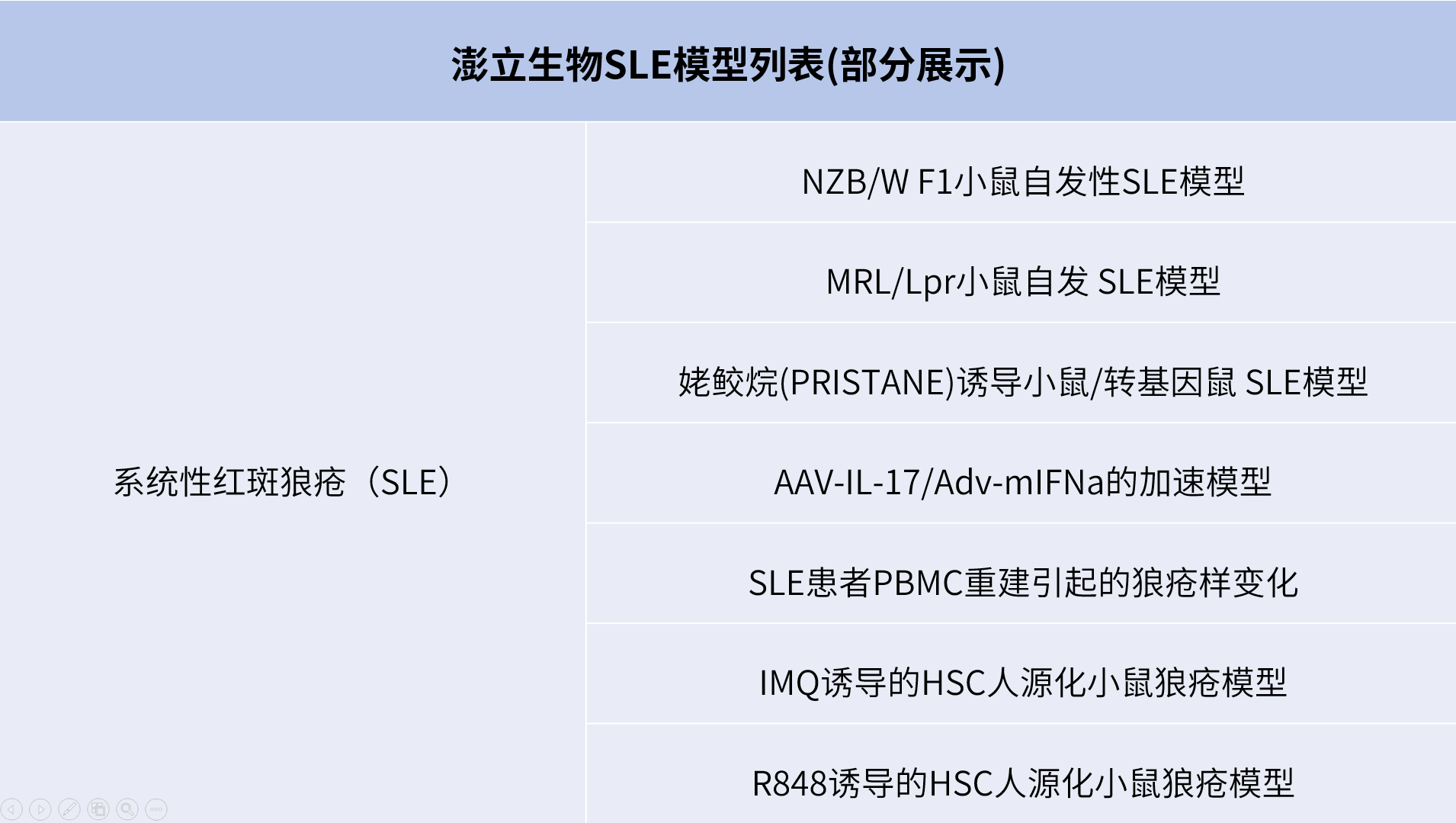
澎立生物自2008年成立以来,借助公司在自身免疫性疾病领域的强大优势,在SLE的临床前药效评价方面积累了大量的技术经验,尤其是利用自发性SLE小鼠模型(包括MRL/lpr小鼠和NZB/WF1小鼠),为国内外超过700家客户成功提供临床前的药理、药效评价服务。
该研究首次明确IL-36作为IL-17拮抗剂“理想搭档”的价值,为LN治疗提供了三大突破:
机制创新:从“单一靶点”转向“炎症网络干预”,精准阻断IL-17/IL-36协同通路;
疗效提升:双靶点治疗可直接作用于肾脏局部炎症,为难治性LN患者提供新选择;
临床转化:基于现有IL-17拮抗剂(如司库奇尤单抗)与IL-36R抗体(已获批用于脓疱型银屑病),双靶点联合治疗的临床研究有望快速推进。
未来研究将聚焦于:
在大型动物(如食蟹猴)LN模型中验证双靶点药物的长期疗效;
开发同时靶向IL-17与IL-36的双特异性抗体,简化给药方案;
开展临床Ib/II期试验,探索最佳剂量与联合用药方案。
原文链接:https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2025.1617451/full