

2025-12-22
模型相关
当你在默默补钙时,你体内的免疫细胞也许正悄悄推动骨量流失,这是绝经后骨质疏松中被长期忽视的关键力量。
骨质疏松症作为骨骼系统疾病,主要表现为骨密度和骨质量下降。骨质疏松分为两大类:原发性和继发性。原发性骨质疏松进一步分为绝经后骨质疏松(I型)、老年性骨质疏松(II型)和特发性骨质疏松。其中,绝经后骨质疏松(PMO)是女性在更年期后5-10年内发生的常见类型,其特征为骨量快速丢失、骨微结构退化,导致骨骼脆性增加和骨折风险上升。值得注意的是,并非所有绝经女性都会患病,个体差异、遗传背景、表观遗传调控、肠道菌群组成及营养模式等因素共同参与其发病机制。
流行病学调查显示,我国50岁以上女性骨质疏松患病率高达32.1%,65岁以上女性更超过半数。更令人担忧的是,髋部骨折后一年内死亡率可达20%,凸显了这一疾病的严重性。
传统观点认为,PMO主要是由于雌激素减少直接破坏了骨骼形成与骨吸收的平衡。然而,最新研究发现,雌激素缺乏不仅影响骨细胞本身,还会引发免疫系统的深度重编程,使其进入慢性低度炎症状态。促炎因子如IL-1β、IL-6、TNF-α水平显著升高,免疫细胞亚群功能紊乱,破骨活动被异常放大。PMO因而从单纯的内分泌疾病被重新定位为一种免疫驱动的炎症性骨代谢疾病。
在雌激素缺乏状态下,免疫系统成为破坏骨代谢平衡的重要因素,形成了复杂的"骨-免疫轴"调控网络:
T淋巴细胞的作用机制:雌激素缺乏可导致CD4⁺T细胞亚群失衡,表现为Th1和Th17细胞比例增加。这些细胞通过分泌TNF-α、IFN-γ和IL-17等促炎因子,一方面诱导成骨细胞凋亡,另一方面通过上调核因子κB受体活化因子配体(RANKL)表达,促进破骨细胞分化成熟。值得注意的是,研究还发现肠道来源的TNF⁺T细胞和Th17细胞可通过CXCR3-CCL20轴迁移至骨髓微环境,建立了肠-骨轴的新调控途径。
B淋巴细胞的功能转变:在生理状态下,B细胞通过产生骨保护素(OPG)抑制破骨细胞分化。然而,雌激素缺乏条件下,B细胞表现出增殖活性增强,粒细胞集落刺激因子(G-CSF)分泌增加,促进破骨前体细胞扩增;同时RANKL表达上调而OPG分泌减少,导致RANKL/OPG比值显著失衡,促进破骨细胞分化。
巨噬细胞的极化改变:雌激素缺乏可导致巨噬细胞极化状态改变,M1/M2比例显著升高。M1型巨噬细胞通过释放TNF-α、IL-6、活性氧等因子抑制成骨分化;而M2型巨噬细胞在RANKL存在且雌激素缺乏条件下,可通过雌激素受体α信号分化为成熟破骨细胞。雌激素通过膜受体和核受体调控PI3K/NF-κB和MAPKs信号通路,影响巨噬细胞极化和细胞因子分泌。
其他免疫细胞的参与:中性粒细胞数量增加、活性增强,通过释放RANKL直接促进破骨细胞分化,同时产生活性氧诱导成骨细胞凋亡。肥大细胞在骨质疏松骨组织中数量显著增加,其活化后释放的组胺(通过H1受体)、TNF-α、IL-6等介质刺激破骨细胞生成。树突状细胞在雌激素缺乏时功能受抑制,可能通过影响T细胞活化间接参与骨代谢调控。
当前内分泌学会发布的关于绝经后女性骨质疏松药理管理的临床实践指南中提出了以下建议:
高骨折风险者:初始治疗推荐双膦酸盐类药物(如阿仑膦酸钠、唑来膦酸)或地舒单抗。
极高骨折风险者:推荐使用骨形成促进剂,如特立帕肽(最长2年)或罗莫佐单抗(最长1年)。
治疗顺序至关重要:骨形成促进剂治疗后必须接续抗骨吸收药物,否则会出现骨密度快速下降。
大量研究已证实,“先促骨形成、再抑制骨吸收”的治疗顺序较传统方案更能带来持续稳定的骨密度提升与骨折风险改善。
虽然目前的临床标准药物主要聚焦于骨重塑本身,但随着“骨-免疫轴”机制的逐渐清晰,围绕免疫调节靶点的新药研发正成为新的热点。例如,靶向 IL-17、TNF-α 或调控巨噬细胞极化的策略显示出潜在价值。值得关注的是,针对包括RANKL、sclerostin、PTH及PTHrP在内的前沿靶点,其药物开发离不开高度专业的临床前研究支持。
澎立生物已深入参与此类药物的研发进程,其经验涵盖关键的临床前药效评价与申报支持工作。这些机制导向型药物对临床前模型的免疫表型要求也随之提高,因此,构建更贴近人类PMO免疫变化的动物模型显得尤为重要。
作为国内最早提供骨疾病临床前研究服务的CRO之一,澎立生物依托先进的骨平台技术,为骨质疏松等骨骼疾病的创新药物研发提供强有力的临床前研究支持。我们致力于通过精准、高效的科研服务,助力科学家们探索更优的治疗策略,为全球骨骼健康事业贡献力量。
服务案例:大鼠去卵巢诱导的骨质疏松模型
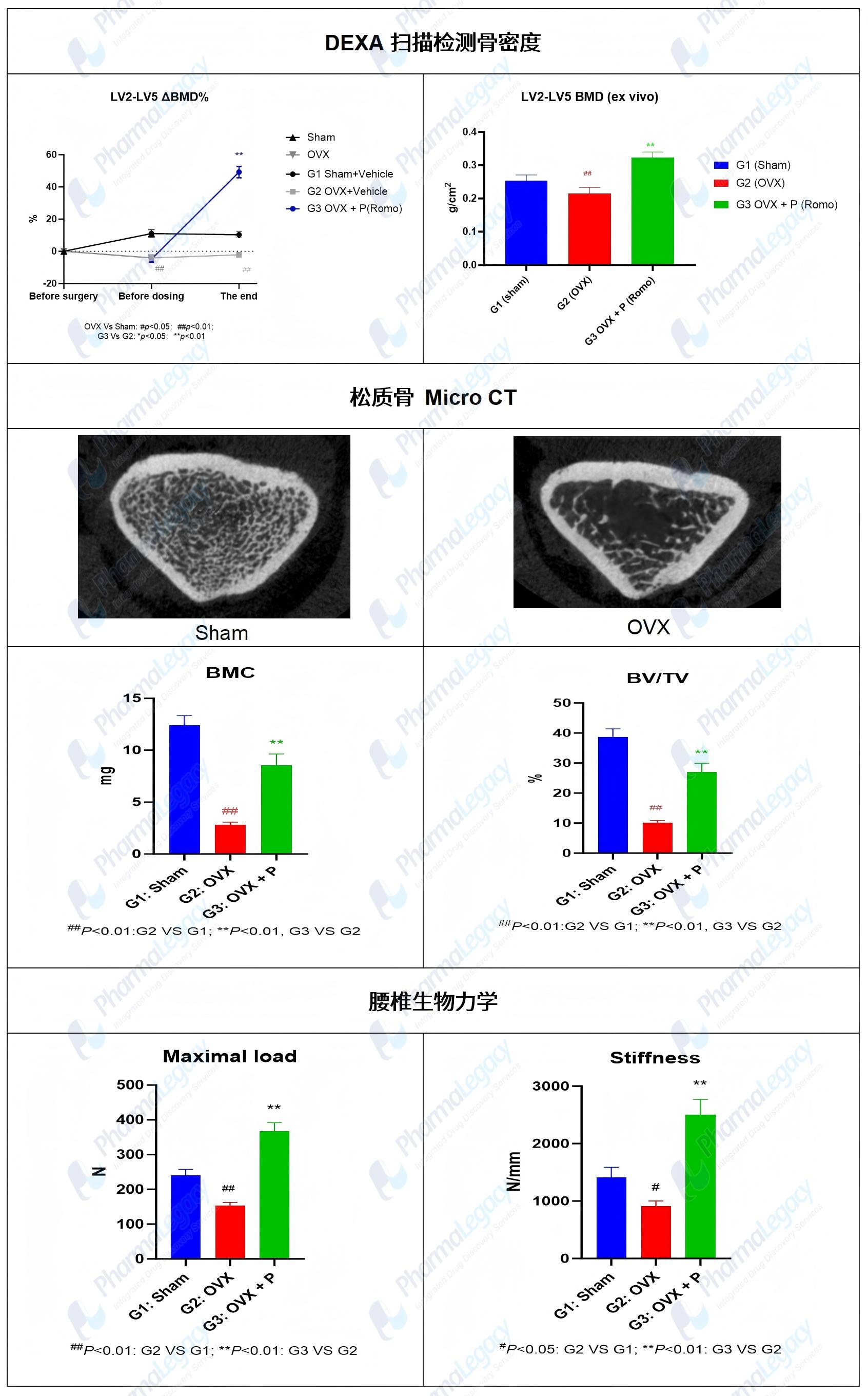
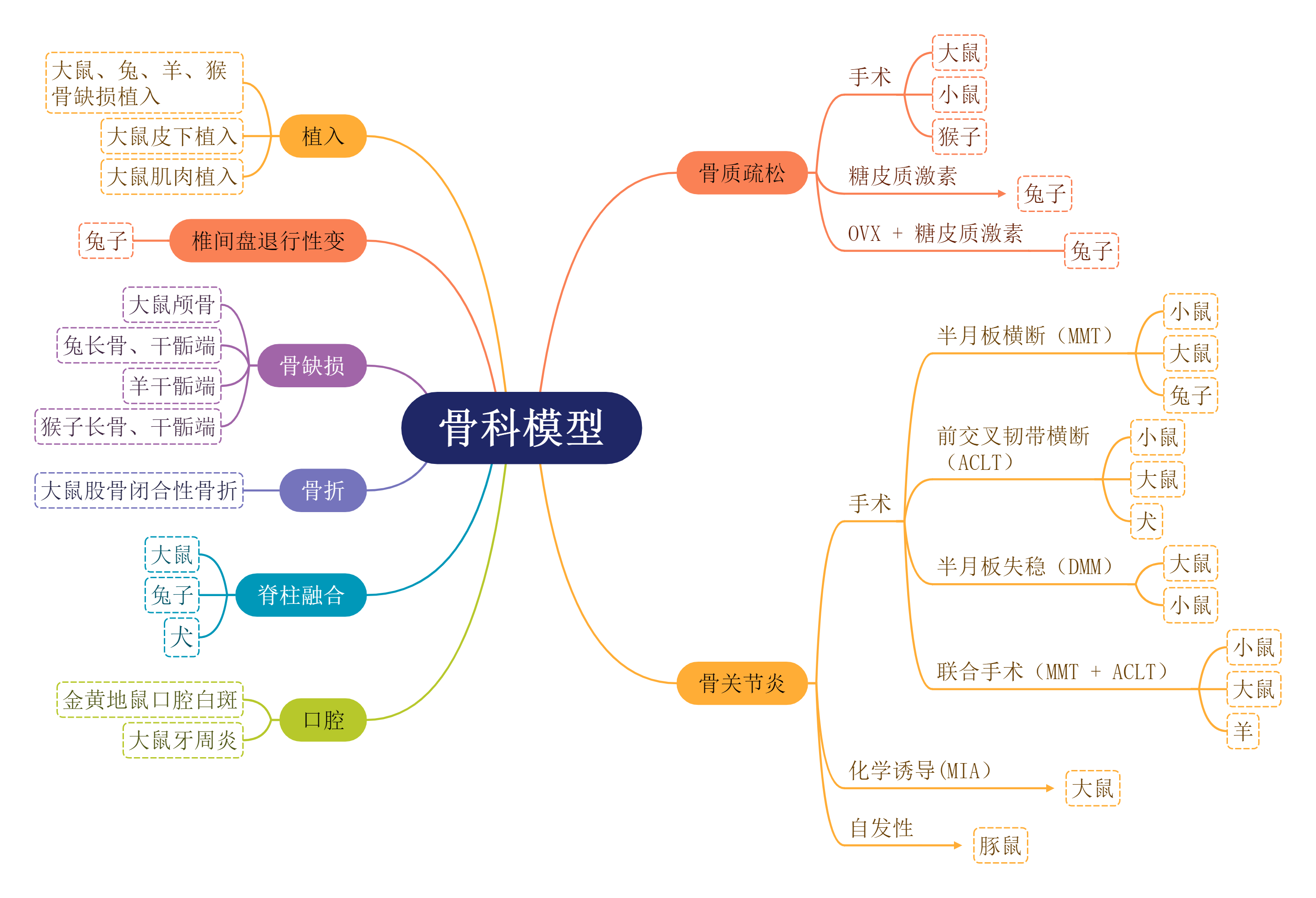
平台模型:
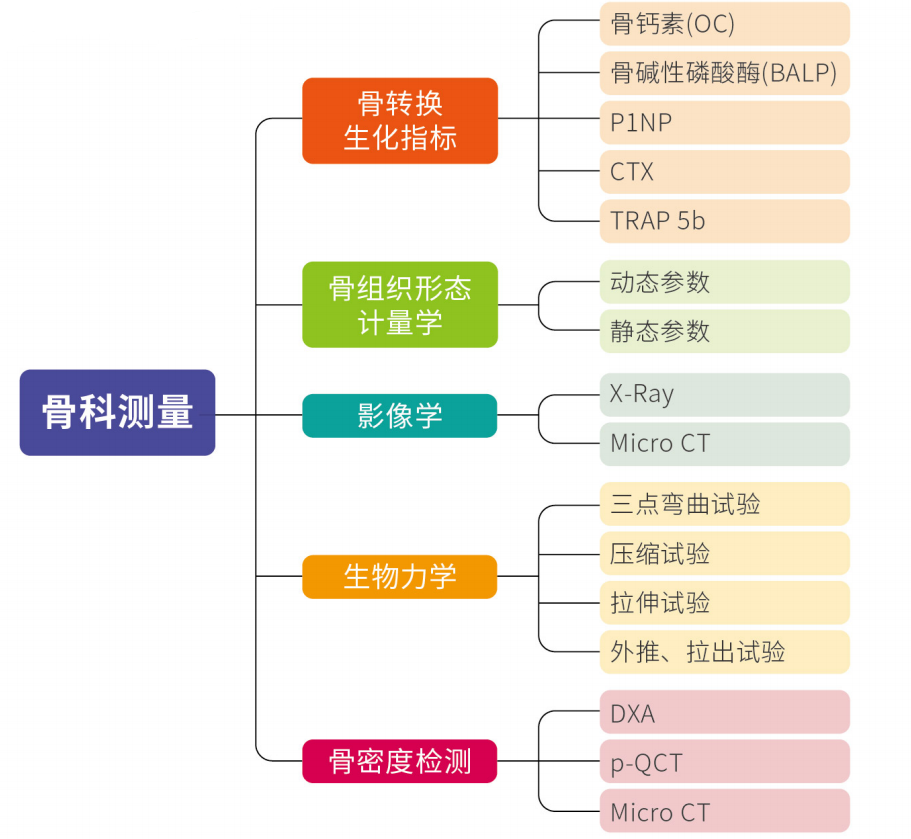
常规检测:
参考文献
[1] 人民网. 卫健委发布首个中国骨质疏松症流行病学调查结果. 2018[EB/OL].http://health. people. com. cn/n1/2018/1019/c14739-30352051. html.
[2] Yao Y, Cai X, Chen Y, Zhang M, Zheng C. Estrogen deficiency-mediated osteoimmunity in postmenopausal osteoporosis. Med Res Rev. 2025 Mar;45(2):561-575.
[3] Fischer V, Haffner-Luntzer M. Interaction between bone and immune cells: Implications for postmenopausal osteoporosis. Semin Cell Dev Biol. 2022 Mar;123:14-21.
[4] Brown JP. Long-Term Treatment of Postmenopausal Osteoporosis. Endocrinol Metab (Seoul). 2021 Jun;36(3):544-552.
[5] Shoback D, Rosen CJ, Black DM, Cheung AM, Murad MH, Eastell R. Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society Guideline Update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
[6] Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body JJ, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018 Jan 20;391(10117):230-240.
[7] Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med. 2017;377:1417–27.
[8] Cosman F, Nieves JW, Dempster DW. Treatment sequence matters: anabolic and antiresorptive therapy for osteoporosis. J Bone Miner Res. 2017;32:198–202.
[9] McClung MR. Role of bone-forming agents in the management of osteoporosis. Aging Clin Exp Res. 2021;33:775–91.