

2025-07-02
模型相关
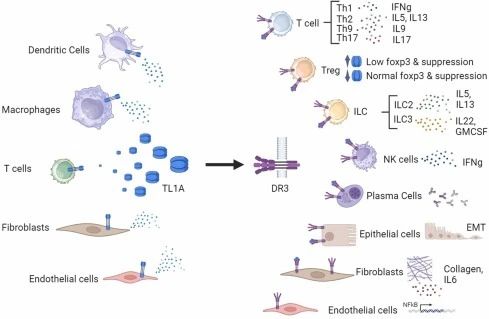
肿瘤坏死因子样配体1A(TL1A,基因名称TNFSF15)是TNF细胞因子超家族的重要成员,其唯一已知受体为死亡受体3(DR3)。TL1A–DR3信号通路在肠黏膜免疫中扮演着关键角色,既参与固有免疫的初始防御,又调控适应性免疫的扩增和调节。在炎症性肠病(IBD)患者的炎症组织中,TL1A及DR3均显著高表达;TL1A过表达不仅与肠道炎症程度密切相关,还会加剧组织纤维化,特别在克罗恩病(CD)相关肠道狭窄中具有明显作用。基因关联研究进一步证明,TNFSF15和TNFRSF25的多态性与IBD的易感性和病情严重度息息相关。
TL1A通过结合DR3,协同激活多种免疫细胞——包括辅助性T细胞、调节性T细胞和先天淋巴细胞(ILC)——大量分泌IFN-γ、IL-17、IL-13等促炎因子,放大局部炎症反应;与此同时,TL1A还能直接作用于成纤维细胞,诱导其增殖、迁移并分泌胶原,驱动组织纤维化。由此可见,中和TL1A不仅能够抑制炎症级联反应,还可能逆转病理性纤维化,为IBD等自身免疫疾病开辟了全新的治疗途径。近年来,多款TL1A单抗和多特异性抗体在2/3期临床中表现较佳,为难治性溃疡性结肠炎(UC)和克罗恩病(CD)患者带来了新的希望。同时这一进展引发了多起巨额资本交易,进一步引发了对该靶点的高度关注。
 10.1016/bs.apha.2024.10.014
10.1016/bs.apha.2024.10.014
一、全球TL1A抗体研发管线概览
目前全球已有多款针对TL1A的抗体药物进入临床阶段,包括单克隆抗体和双/多特异性抗体。主要产品及其开发状态如下:
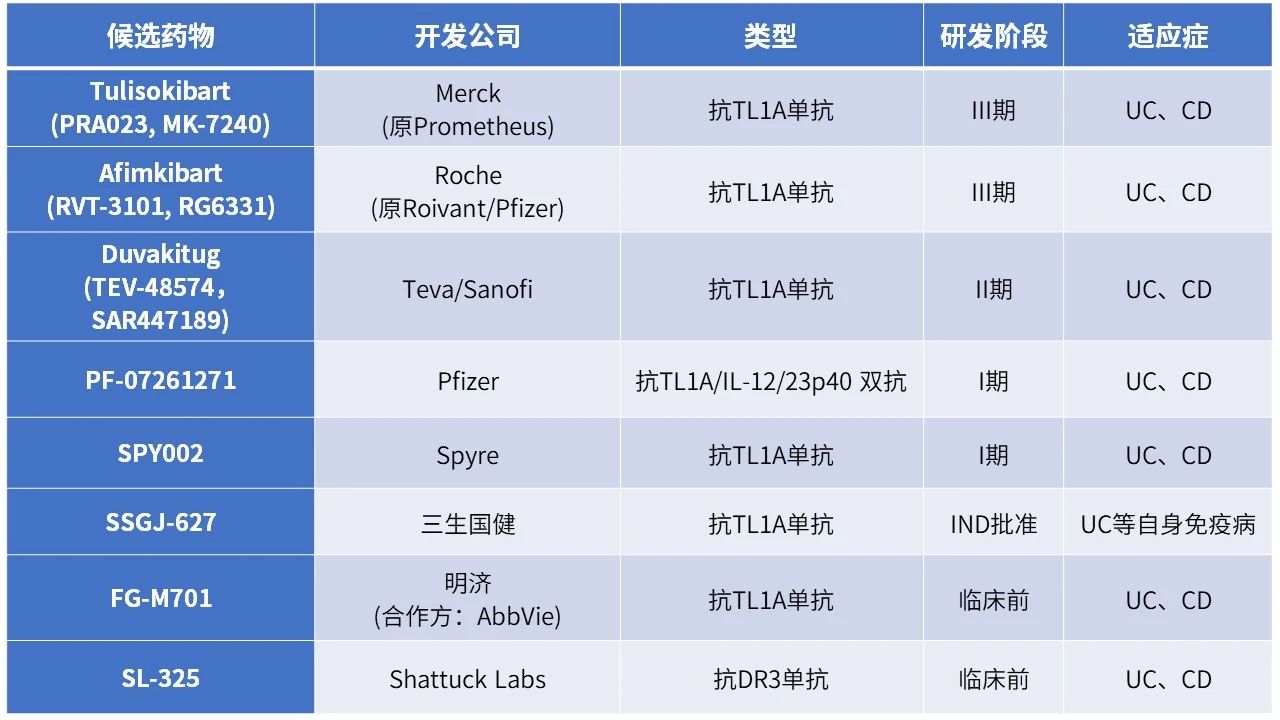
目前进度最为领先的Tulisolibart和Afimkibart均已进入三期临床,两者在二期临床中公布的数据显示其在中重度活动性溃疡性结肠炎患者中均具有良好的疗效,且长期维持数据显示了良好的安全性和耐受性。
二、作用机制与前沿研究
TL1A由活化的抗原提呈细胞(树突细胞、巨噬细胞等)和内皮细胞分泌,在炎症环境中表达上调。TL1A与DR3结合后,共刺激Th1/Th17细胞和ILC(如ILC1/ILC3),增强IL-12和IL-23介导的下游信号(如STAT3/STAT4通路),促进效应T细胞和ILC大量产生IFN-γ、IL-17等促炎细胞因子,加剧黏膜炎症反应。此外,肠道成纤维细胞高表达DR3,TL1A-DR3信号可激活成纤维细胞,诱导其分泌胶原、α-SMA等细胞外基质成分,并促进其增殖和迁移,最终导致肠道纤维化及肠腔狭窄,推动慢性炎症向组织重塑进展。
TL1A既由树突状细胞和巨噬细胞等天然免疫细胞在微生物或TLR刺激下快速诱导产生,又通过其受体DR3作用于天然淋巴细胞和适应性T细胞,在肠黏膜屏障免疫中搭建了先天与获得性免疫反应之间的桥梁,使其成为一个良好的靶点。研究显示,阻断TL1A/DR3信号能够缓解肠道炎症并逆转纤维化指标。在TL1A过表达的小鼠模型中,自发性肠炎并伴明显的纤维化,给予抗TL1A抗体或敲除DR3后,可显著缓解炎症和胶原沉积;在体外,TL1A与IL23协同刺激可增强外周血单核细胞的IL17分泌,阻断TL1A则显著降低促炎趋化因子和黏附分子的表达,减少炎症细胞浸润。
综上所述,TL1A作为炎症和纤维化的双重驱动因子,通过中和TL1A有望同时抑制炎症级联反应和病理性纤维化,为IBD等疾病提供区别于现有疗法的新型作用机制。
三、适应症扩展与潜力展望
尽管目前主要的领先的TL1A项目多聚焦于IBD适应症,然而TL1A-DR3通路的特性决定在其他免疫疾病中也可能起到相当的病理作用,TL1A抗体疗法可预见的适应症扩展方向包括:
1,哮喘和嗜酸性炎症性肺病:TL1A被证明是气道炎症的促发因子之一,可放大ILC2介导的Th2型免疫反应。在重度哮喘患者中,气道重塑和纤维化是难以控制的病理过程,TL1A阻断有望降低IL-13等介质,从而减轻气道高反应和组织重构。一些学术研究已提出将抗TL1A疗法用于嗜酸粒细胞性哮喘或慢性阻塞性肺疾病(COPD)的重度亚型。
2.银屑病与特应性皮炎:TL1A在皮肤免疫中也有一定作用。有研究在银屑病皮损中检测到TL1A过表达,与炎症程度相关。特应性皮炎是一种Th2为主的慢性炎症性皮肤病,IL-13和IL-22等因子致病显著,而TL1A可能通过影响这些细胞因子的产生而介入疾病过程。虽然目前尚无TL1A抗体在皮肤病的临床研究,但机制共通性为其提供了理论支持。
3,系统性硬化症/肝纤维化:TL1A被明确认为是组织纤维化的重要推动因子。这意味着在肺纤维化、肝纤维化等疾病中,TL1A通路可能同样活跃。例如,特发性肺纤维化(IPF)患者肺泡巨噬细胞可能产生TL1A导致成纤维细胞异常活化。阻断TL1A是否能延缓IPF进程值得探索。同理,在MASH以及肾脏纤维化病变中,TL1A抑制剂可能发挥一定的抗纤维化作用。TL1A+LIGHT多抗(如VTC-890等)在临床前纤维化模型中已有积极表现。
4,RA、SLE等免疫病:TL1A在某些自身免疫病(如类风湿关节炎、红斑狼疮)中也有报道涉及,虽然这些疾病已经有多种成熟生物制剂,但在常规治疗,比如TNF-a不响应患者中,TL1A+TNF-a联用仍可能有一定的价值。此外,在IBD患者的肠炎外症状,或合并哮喘、肺纤维化人群,TL1A抑制剂或多抗可提供一体化治疗策略。
作为该领域的领先者,Tulisolibart和Afimlibart的相关适应症拓展工作已经进展到了II期临床。

四、TL1A的多靶点组合策略
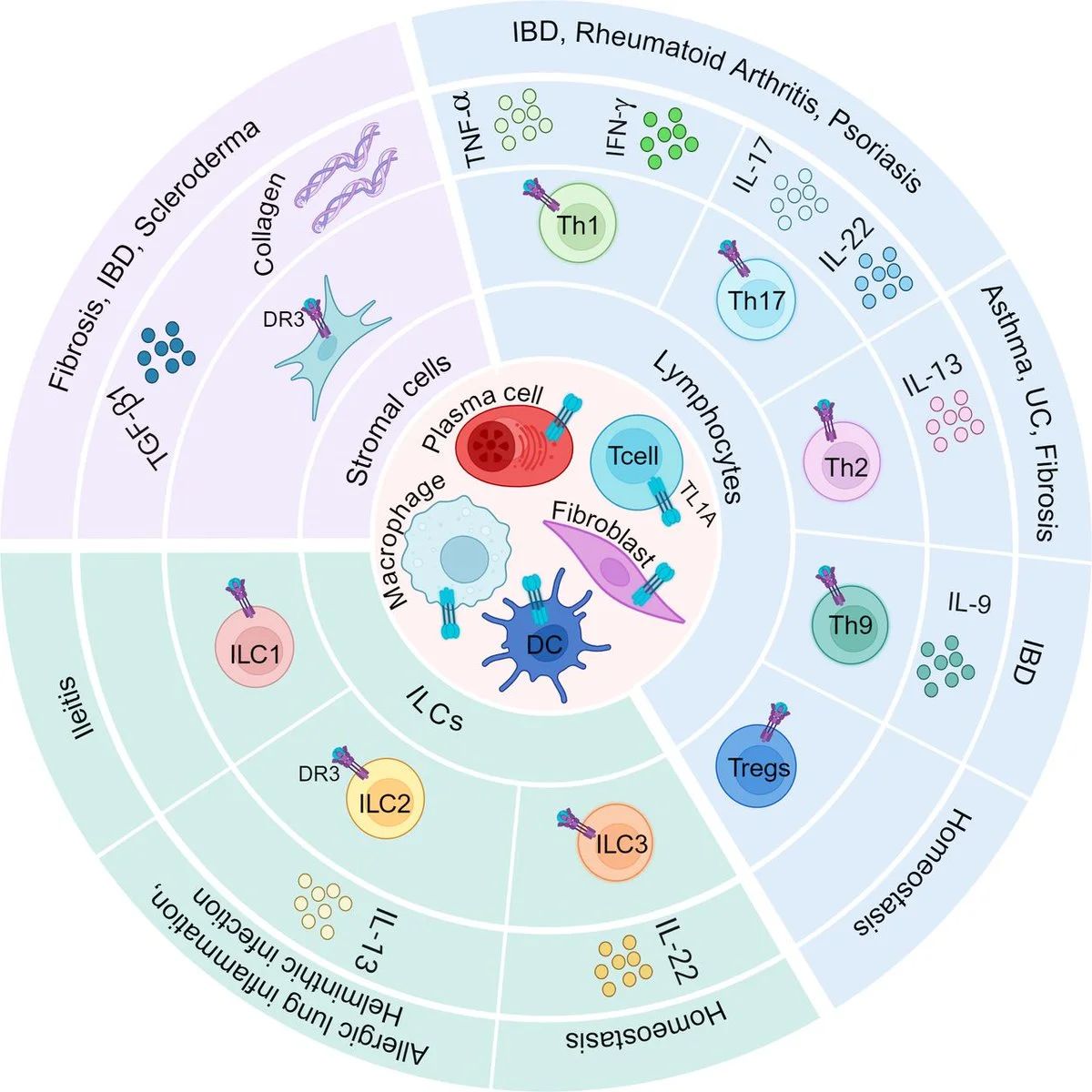
为了更好的发挥TL1A与通路中其它参与因子的协同作用,多家公司正开发TL1A相关的多特异性抗体,以发挥更好的治疗作用,例如:
1.TL1A + IL-23p19(SPY-230, HXN-1003):IL-23在Th17细胞介导的炎症中起关键作用,同时靶向TL1A和IL23,可发挥协同性抗炎作用。
2.TL1A + α4β7(SPY-120, HXN-1002):α4β7整合素在淋巴细胞向肠道的迁移中起重要作用,同时靶向炎症因子与免疫细胞迁移,在IBD中可以体现出更好的药效。
3.TL1A + LIGHT (VTC-890):LIGHT在系统性硬化症(SSc)等纤维化疾病中发挥作用。通过组成双抗,在抗炎的同时,加强了抗纤维化作用。除针对IBD外,还可用于系统性硬化症(SSc)和肺纤维化IPF等适应症。
4.TL1A + TNF-α:TNF-α是IBD治疗中的经典靶点,同时靶向IBD中最主要的两大炎症因子,可能会有更强的治疗效果。除IBD外,对RA,SLE等疾病,特别是TNF-a经治不敏感人群有较大的潜力。
五,相关适应症的临床前评价
TL1A及相关多抗通过多靶点协同作用,有效拓展了适应症范围。根据公开报道,目前常见的相关药物在筛选及申报阶段所使用的疾病模型有:
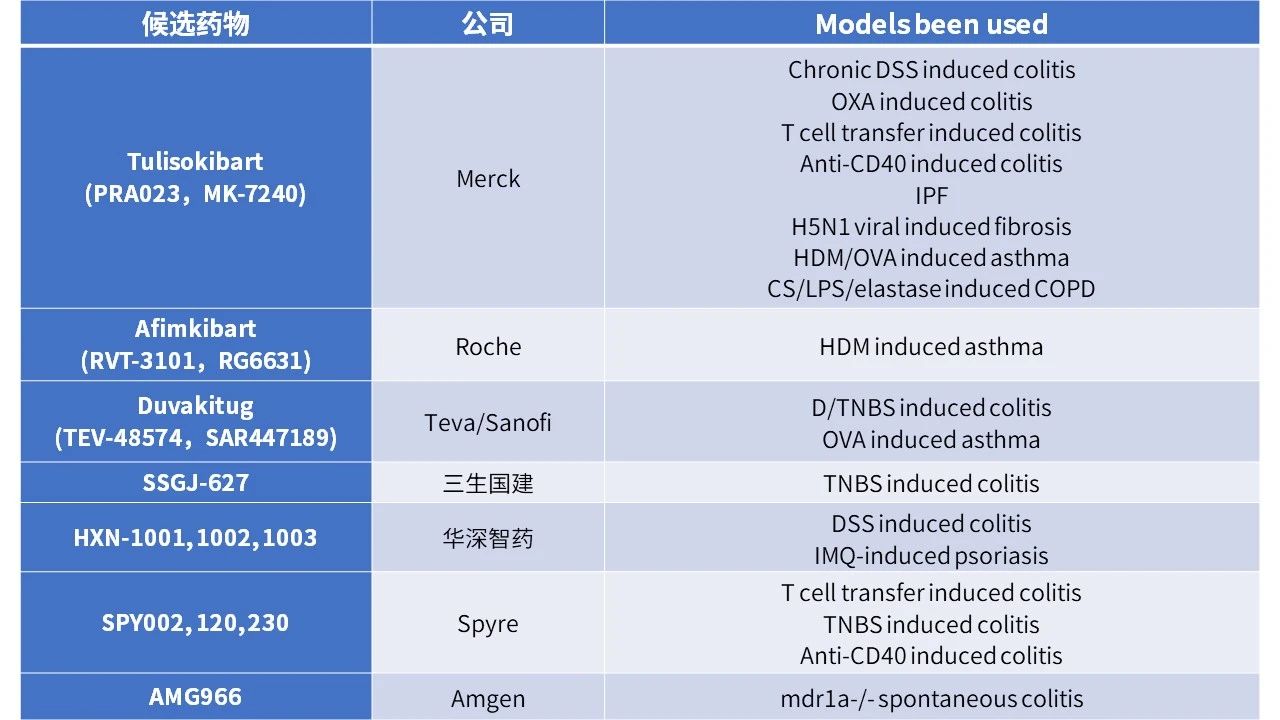
澎立生物在 TL1A 肠炎治疗、多抗 / 多靶点联合用药开发领域经验丰富,可提供 TL1A 相关药物研发所需的绝大多数疾病模型。同时搭建了涵盖普通大小鼠、基因编辑动物、人源化免疫系统小鼠及食蟹猴的多物种实验平台,能根据药物特性灵活匹配动物种属与疾病模型。
澎立生物部分案例数据展示如下
Crohn’s disease:
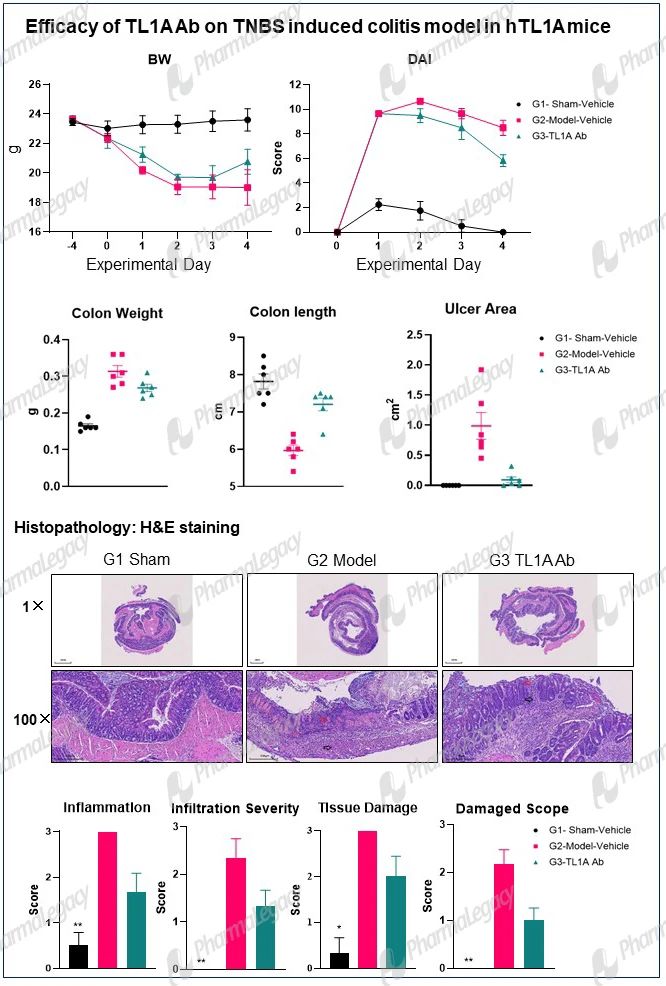
Ulcerative Colitis:
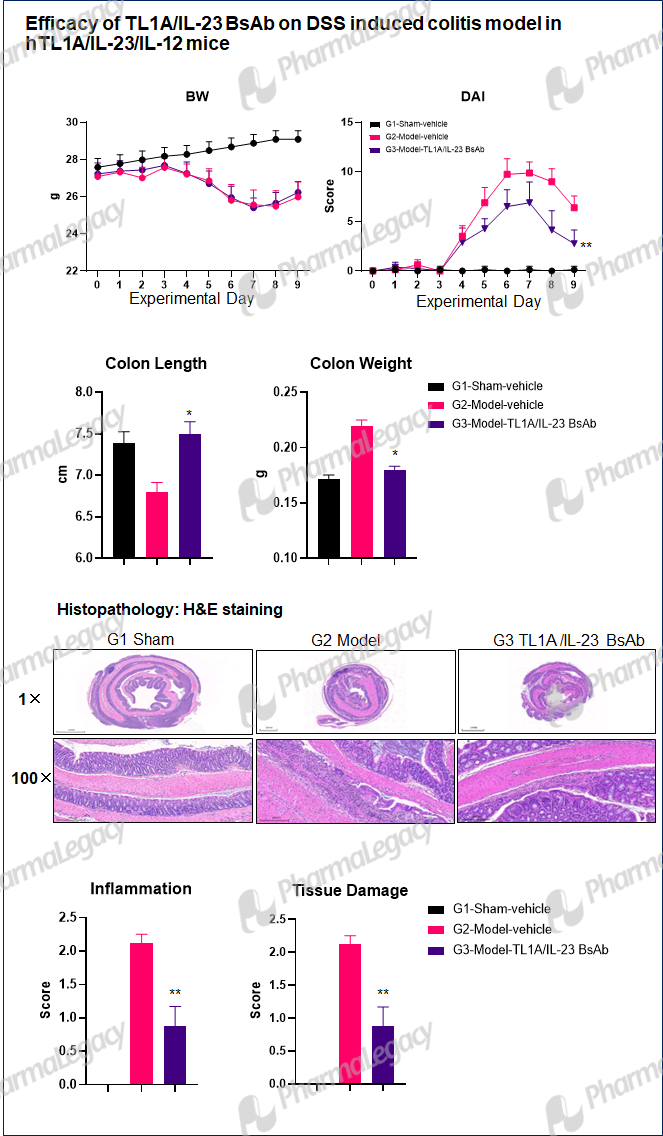
Rheumatoid Arthritis:
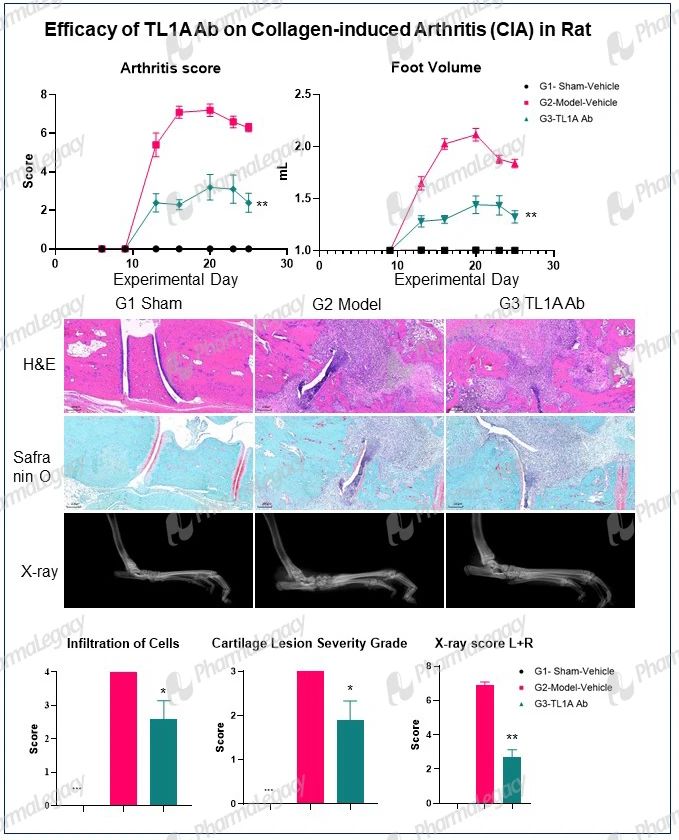
Psoriasis:
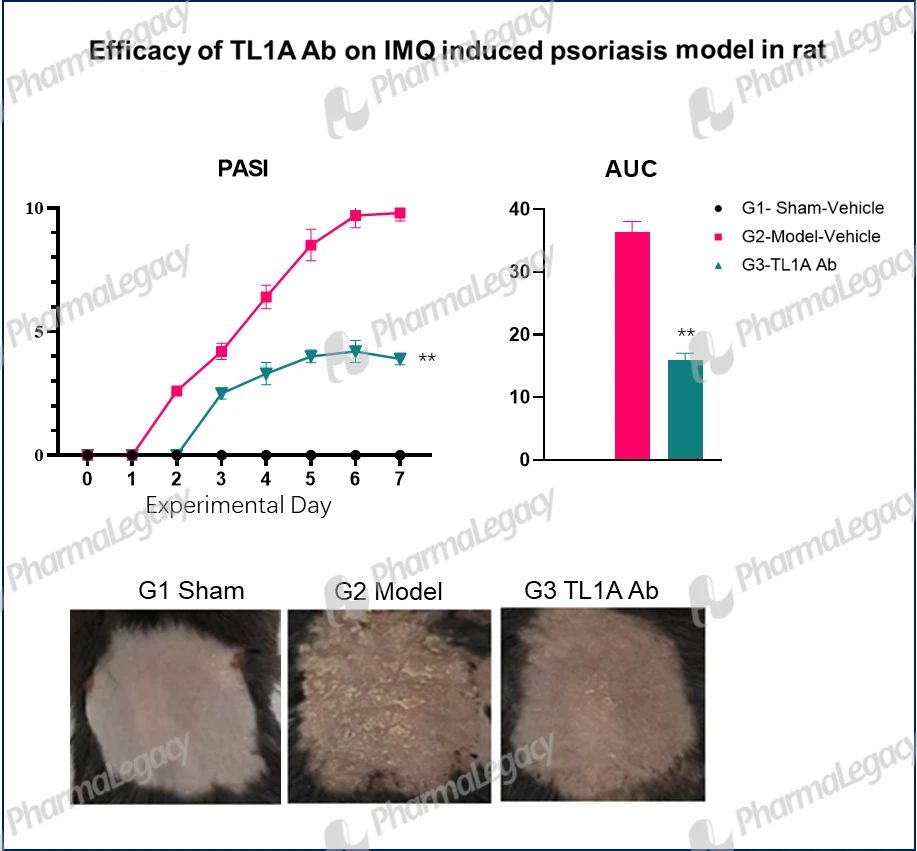
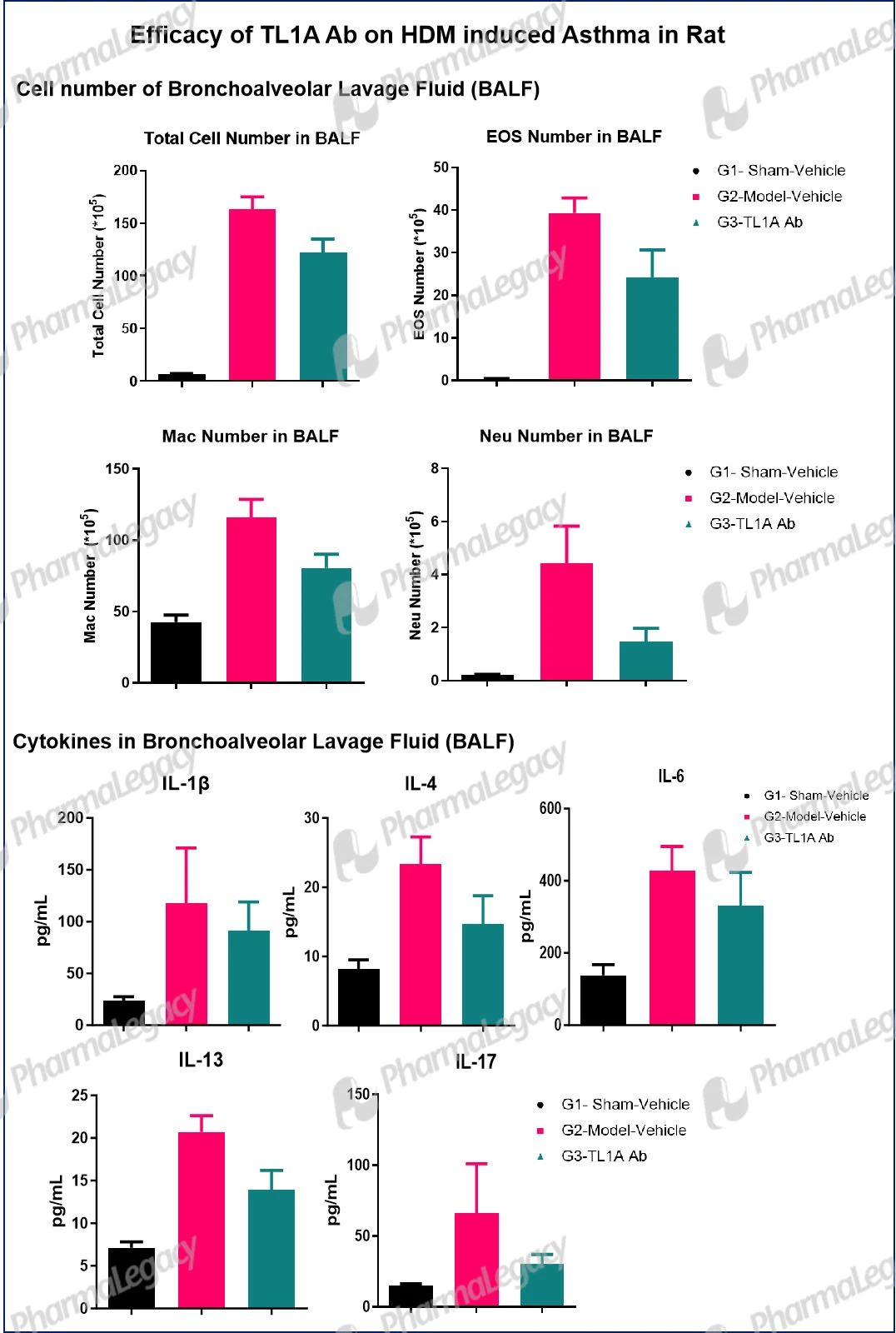
Asthma:
TL1A单抗及其多特异性抗体正逐步改写IBD和相关免疫疾病的治疗格局。凭借双重机制、疾病人群分层与多抗技术进步,这一新兴靶点有望成为继TNF-a、IL-23之后的又一“百亿级”核心靶点。随着更多III期数据出炉,预计TL1A相关药物将在未来几年内迎来商业化突破,并广泛应用于多种难治性免疫和纤维化疾病的管理和治疗。欢迎业内同仁携手共进,加速这一创新疗法的临床转化。