

2024-06-19
模型相关
炎症性肠病(Inflammatory Bowel Disease,IBD),包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)两种类型,这些炎症可引起腹泻和腹痛,临床上这些症状反复发作,给患者带来极大的痛苦。目前临床针对IBD患者的药物治疗主要包括5-氨基水杨酸,糖皮质激素(如泼尼松、布地奈德等),免疫调节药物(如环孢素、甲氨蝶呤等),生物制剂(如抗TNF抗体、抗整合素α4β7抗体等),小分子靶向药物(如Janus kinase抑制剂、Sphingosine-1-phosphate (S1P) receptor调节剂等),抗生素(如甲硝唑、环丙沙星)以及益生菌等。然而,现有的治疗手段很少能够实现临床治愈,现有药物响应率大多数在30%以下,临床仍亟需新的药物或治疗手段来满足相关需求。
最近的研究发现,TL1A(又称TNFSF15是肿瘤坏死因子家族的一员),在多种自身免疫性疾病组织中异常表达,包括澎立公司现有的炎症性肠病类、风湿关节炎、银屑病、原发性胆汁性肝硬化、系统性红斑狼疮和强直性脊柱炎的疾病模型,以及在2018年完成的哮喘模型中的抗体药效评价。从细胞水平上看,TL1A在活化的巨噬细胞、树突状细胞,T细胞等免疫细胞上高表达,也在非免疫细胞(如滑膜成纤维细胞、内皮细胞)中表达。从作用机制上来看,TL1A通过其DR3受体在肠道炎症级联和纤维化中起关键作用,信号通路如下图。TL1A还可以协同促进IL-4、IL-12和IL-23的产生,并通过Th1、Th2和Th17细胞增加DR3的表达,以促进炎症。
目前,全球范围内已有多款TL1A抗体正在开发中,从积极的临床数据来看,针对TL1A靶点的药物有望用于治疗溃疡性结肠炎、克罗恩病等多种自身免疫性疾病。
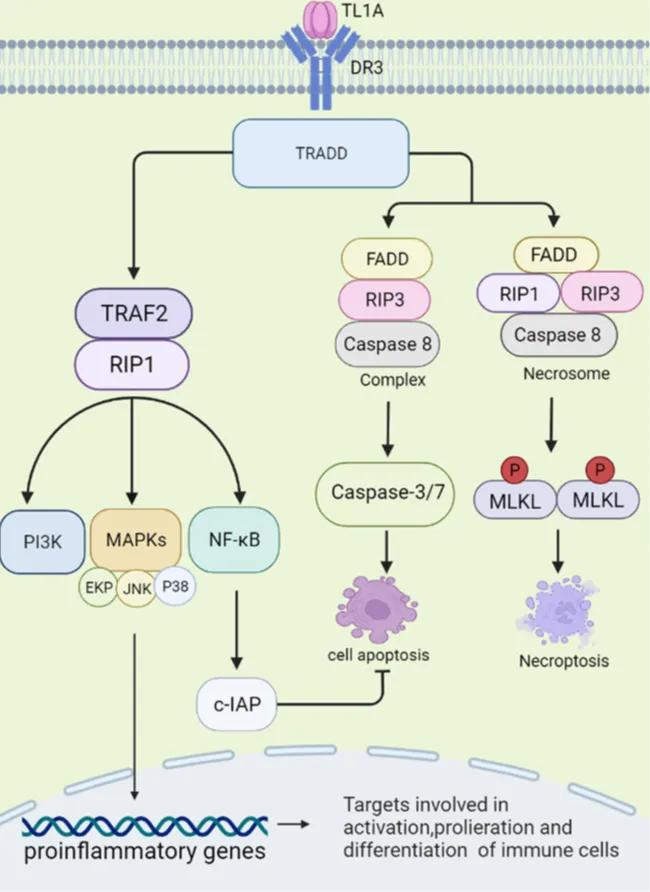
TL1A/DR3信号通路
Front Immunol. 2022, 13: 891328
TL1A 与受体 DR3 结合并激活 TRADD 通路。该复合物通过调节TRAF2、RIP1、PI3K、MAPKs、NF-κB等下游通路发挥促炎作用,进而调节细胞因子、趋化因子的分泌。TL1A/DR3 通过 FADD、RIP3、Caspase-8/-3/-7 途径参与促进细胞凋亡和坏死性细胞死亡。NF-κB可以激活c-IAP蛋白,从而负向调节细胞凋亡。澎立生物自2008年成立以来,一直致力于自身免疫相关疾病的模型开发和临床前药效评价工作,已为国内外超过上百客户提供包括上述IBD在内的各类胃肠道相关疾病的临床前药效评价工作,已于2023年完成了TL1A单抗在UC和CD相关的动物模型中的药效验证。
01 CD动物模型
临床CD的疾病特征包括瘘管、包块、脓肿,炎症及透壁性裂隙,病灶常呈高度灶性分布等。TNBS或DNBS作为半抗原可渗入到实验动物结肠组织的固有层,与组织蛋白、肠道微生物蛋白等高分子物质结合,可形成全抗原,使T淋巴细胞致敏,引起肠壁的固有免疫和适应性免疫反应,进而诱导构建CD动物模型。
TL1A 在CD动物模型中的药效评价(澎立生物):
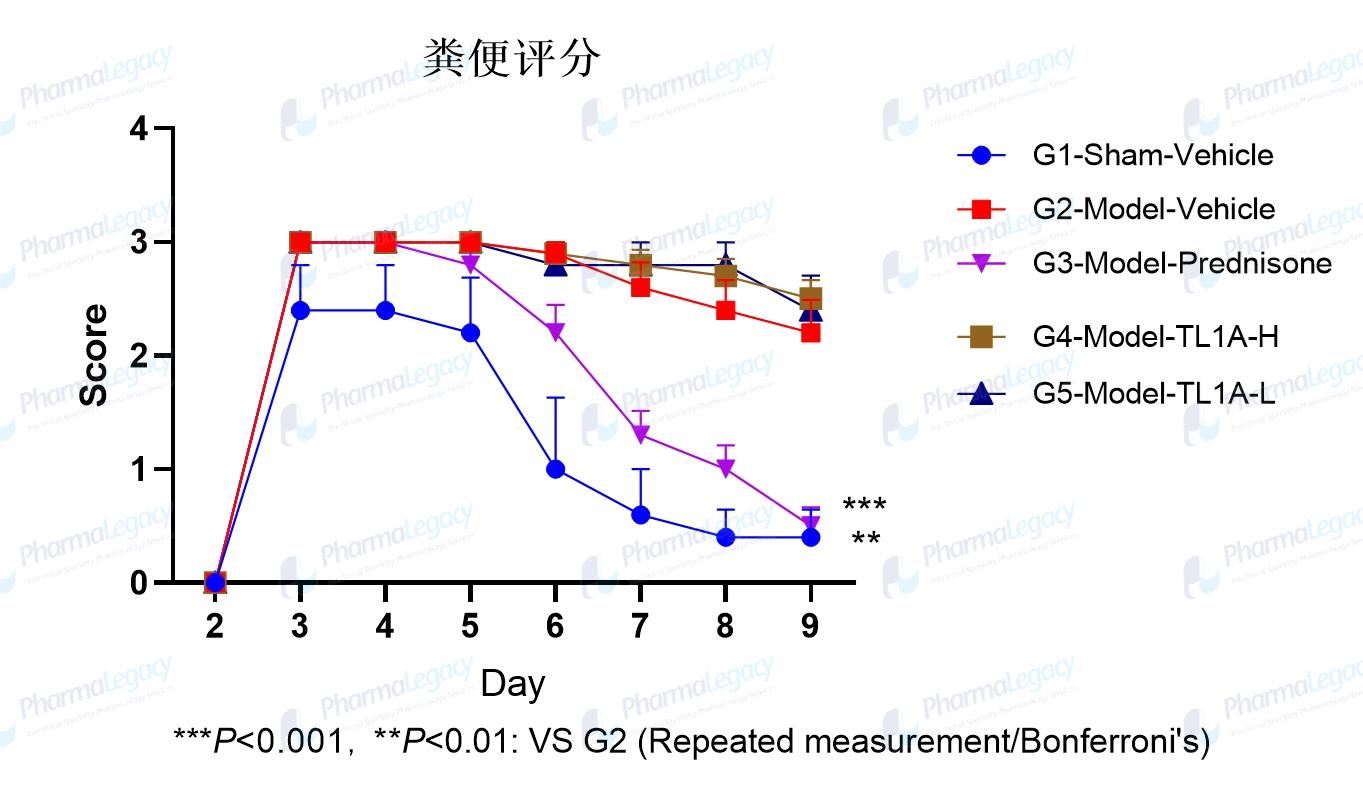
CD动物模型的结肠灶性分布病灶,包块、脓肿,透壁性裂隙(澎立生物):

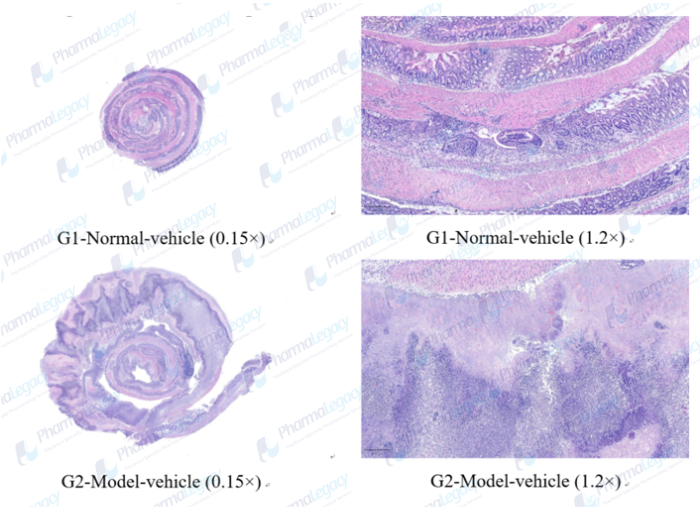
CD动物模型的结肠炎性细胞浸润和组织损伤病理图片(澎立生物):
CD动物模型的结肠纤维化和新生黏膜病理图片(澎立生物):
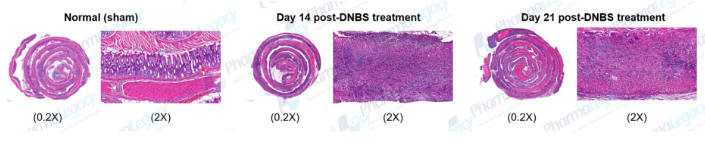
02 UC动物模型
临床UC的疾病特征包括无瘘管形成,呈现均一连续性炎症改变,炎症局限于黏膜层(除严重病例外)等。DSS可对实验动物肠上皮造成化学损伤,导致肠固有层(LP)和黏膜下层暴露于抗原和肠道细菌,引发炎症,进而诱导构建UC动物模型。
TL1A 在UC动物模型中的药效评价(澎立生物):
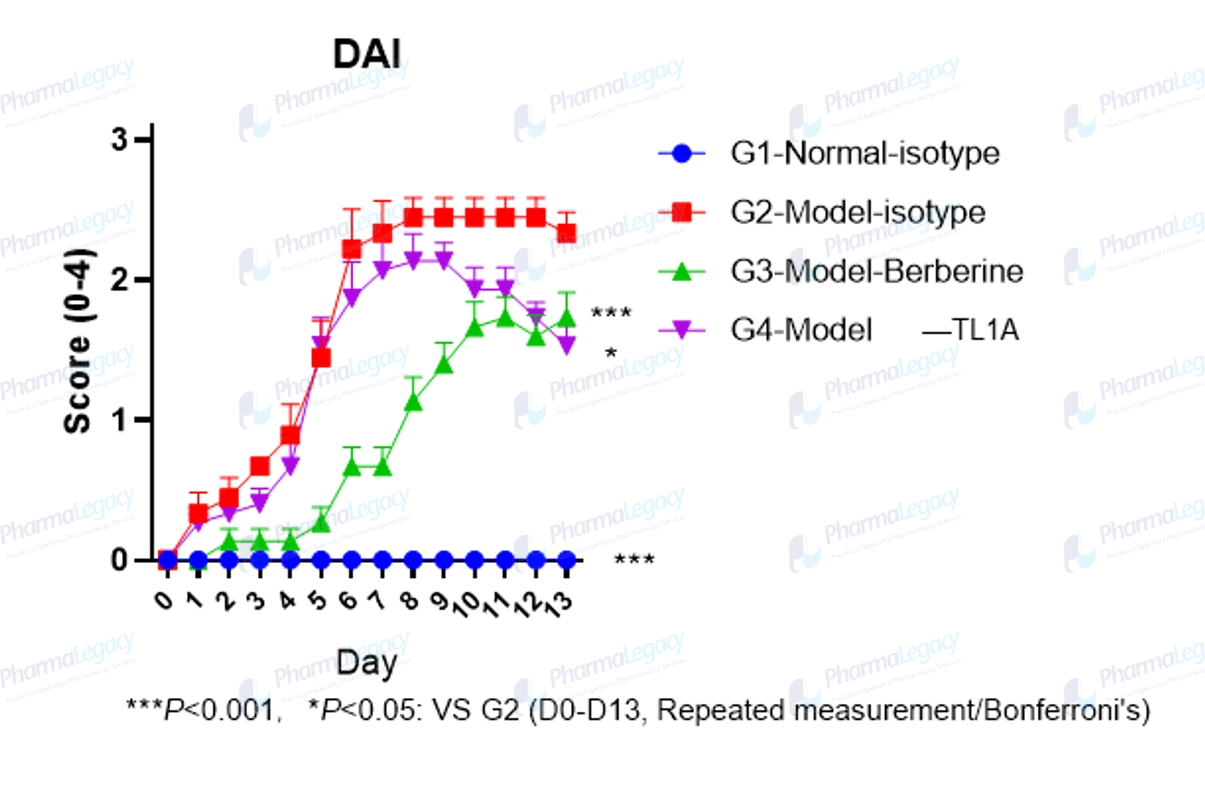
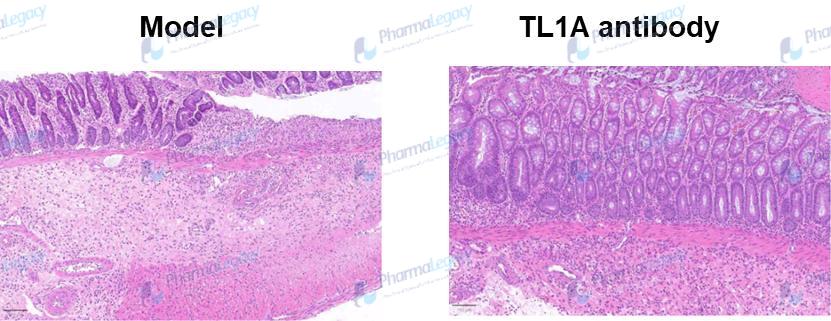
UC动物模型的结肠炎性细胞浸润和组织损伤病理图片(澎立生物):
请与我们联系,以获得其它科学数据;更多肠炎模型正在开发中,欢迎大家咨询合作。