

2023-06-30
模型相关
近日,在刚结束的杭州“BioCon第十届国际生物药大会暨展览会”中,澎立生物作为深耕临床前药理药效评价服务的卓越CRO企业,受邀在第一天的千人大会中做技术分享。澎立生物肿瘤科学家,就人源化动物模型在细胞及基因治疗领域临床前评价中的应用,在现场进行了题目为《定制化动物模型对细胞和基因治疗的推动》的精彩分享,相关内容在分享结束后也引发了在场观众的热烈提问和讨论。今天我们就来回顾这一精彩的主题内容。
内容梗概:
在FDA取消“动物试验强制令”的背景下,从“No model is perfet, but many are useful ”的角度出发,点出人源化的小鼠是更好的模型选择。结合三篇临床前研究文献,阐释了人源化动物在CAR-T细胞治疗、基因治疗方面临床前评价中的应用,对于人源化动物模型应用中可能的影响因素进行分析。
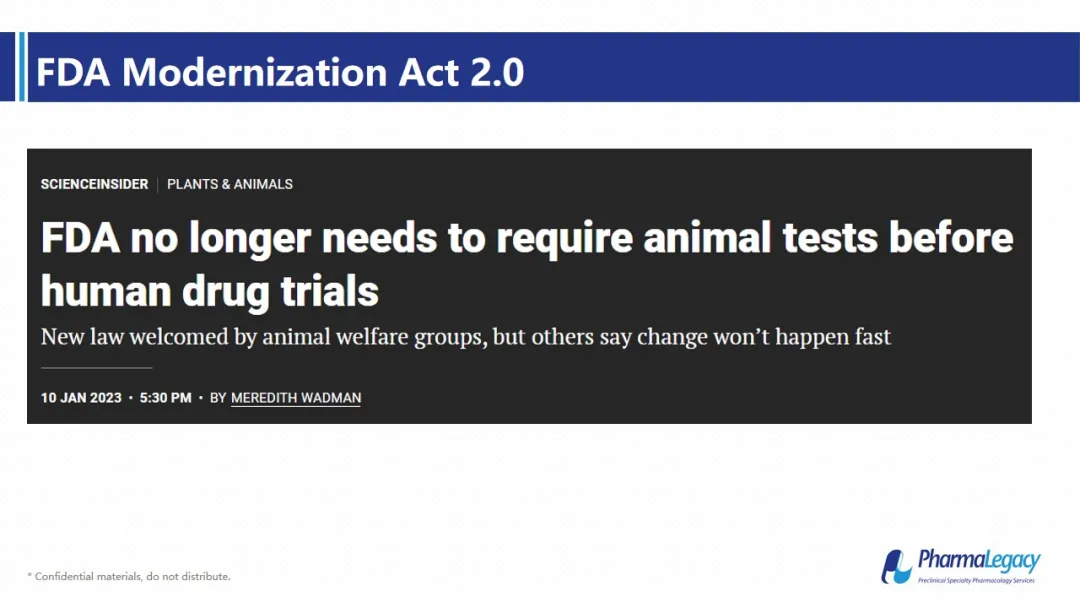
这篇发布日期为2023年1月的消息稿,源于2022年9月29日,美国国会参议院一致同意通过‘’FDA现代化法案2.0”。FDA将授权并认可使用动物试验的某些替代品,来证明药物的安全性和有效性。同时,该法案还取消了生物类似药BLA申请中,关于动物试验的一部分要求。动物实验要被废除了吗?

对比原文我们可以发现:法案此次主要修正部分就是将“animal tests”一词换成了“nonclinical tests,并对“nonclinical tests”一词做出解释:nonclinical tests 包括动物实验、细胞实验、器官芯片、计算机模型、生物打印等,所以,该法案并没有废除动物实验,只是在动物实验以外提供了更多选择。

图片来源:congress官网
但是毫无疑问,该法案的颁布都是一个积极且现代化的信号,同时也提醒我们不断思考,动物模型将会在未来的临床前研究中扮演什么角色?

虽然没有一个动物模型是完美的,但不等于动物实验是没有用的,更不意味着我们可以离开动物实验。无论是评价药物有效性还、安全性,从某种角度上讲动物实验都是在帮助我们降低风险。我们现在所困扰的,绝大部分在动物实验中显示有效的药物在临床试验中失败,其实更多反映的是动物模型与人体真实疾病之间的差异。如何更好地模拟人类疾病进展,让药物在临床前实验中被评估的更为准确,将会是现代化法案2.0时代临床前动物实验的终极目标。
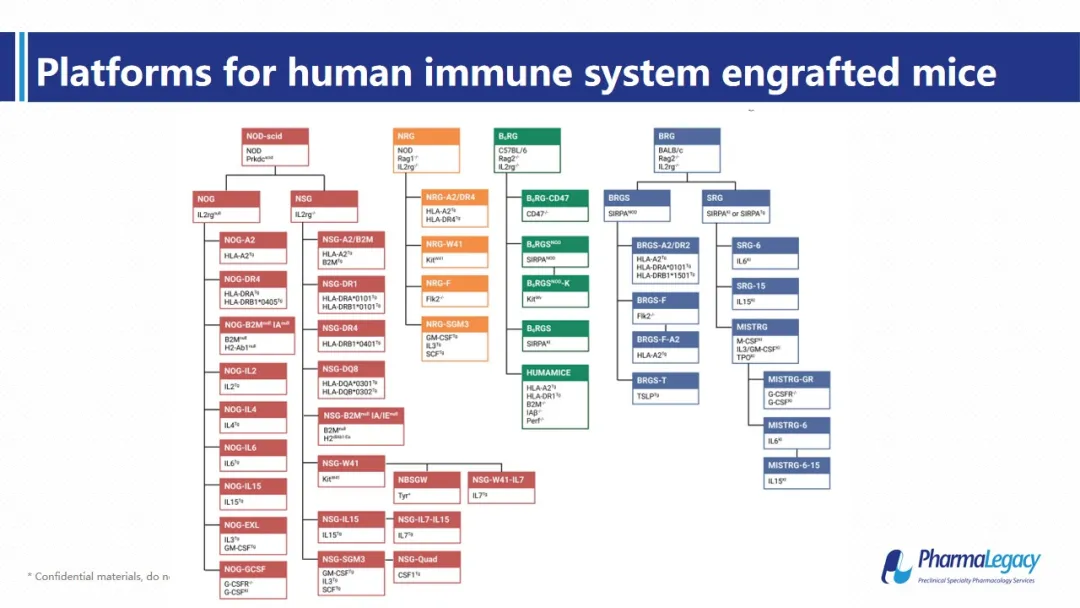
而人源化小鼠无疑是目前最接近这一目标的重要动物模型,在过去的几十年间,经过对免疫缺陷动物不断改造,现如今,已经有多种免疫缺陷小鼠可以用于人源化重建。无论使用哪一种动物品系,人源化的过程都大体相同。
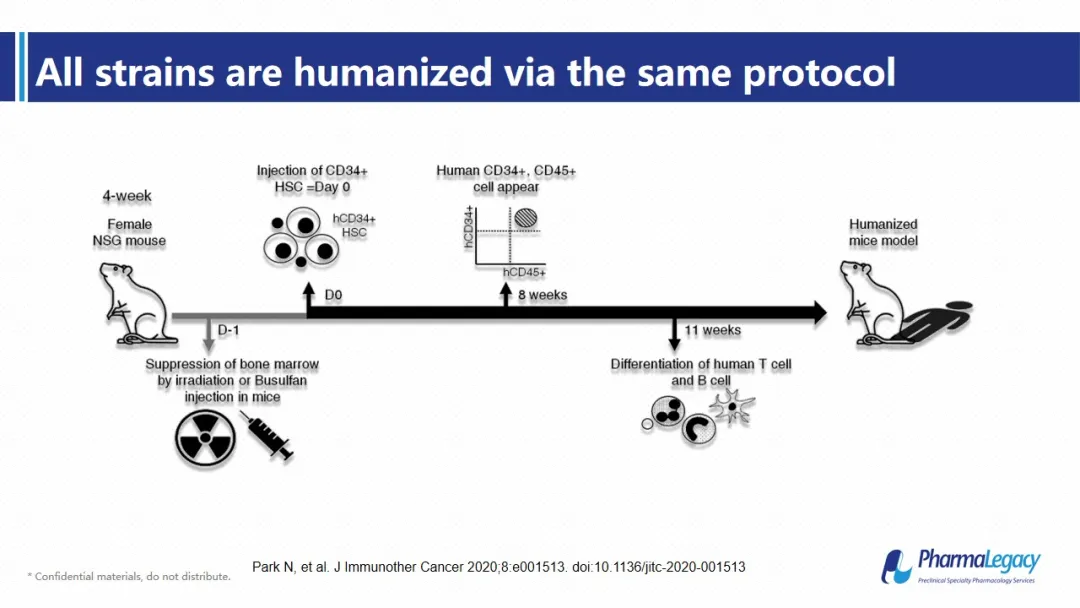
这一过程伴随着造血干细胞向小鼠骨髓归巢、扩增并能长期发挥全谱系造血功能、从而最终形成功能性的体液免疫和细胞免疫反应。
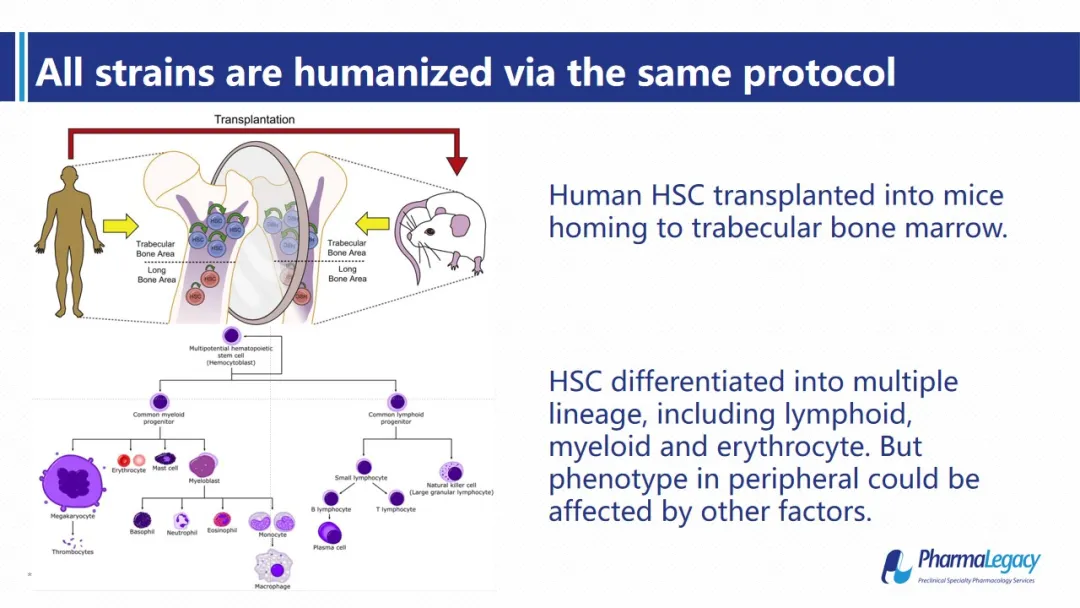
这些人源化小鼠最重要的贡献是:完全模拟了人造血系统的分化和发育过程从而使他们可以成为肿瘤免疫治疗以及基因治疗领域更加精准的临床前动物模型。我们将运用以下几个文献中的例子来加以说明。

第一个想要分享的主题是:人的髓系免疫细胞在CAR-T的安全性及有效性评价中发挥的重要作用。

第一篇来自于nature medicine, 文章分析了CAR-T治疗中CRS产生的原因,免疫细胞亚群,细胞的因子类型及药效的影响。
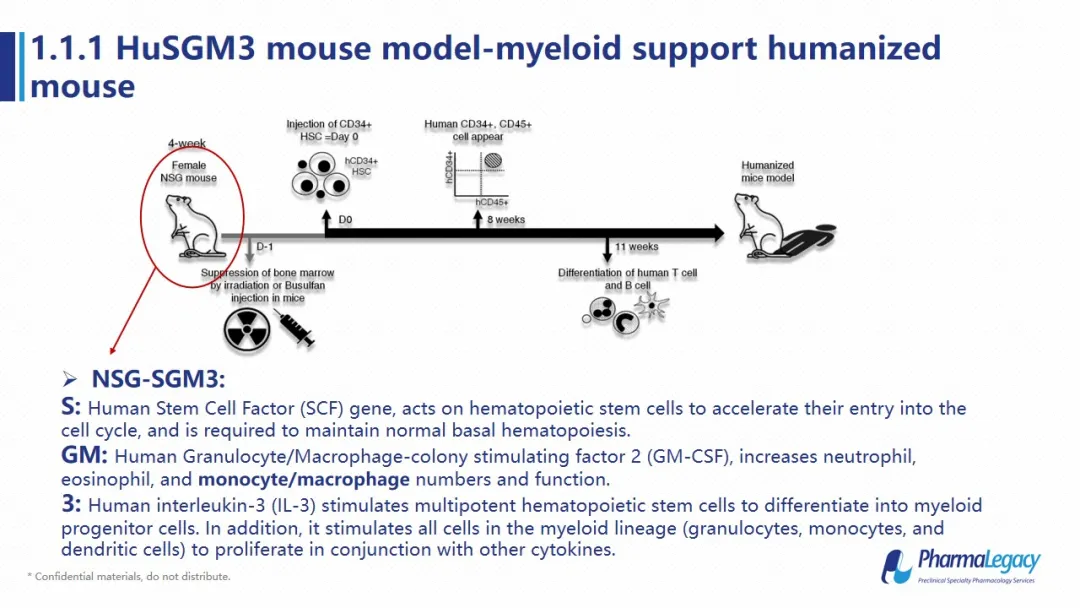
本实验使用的动物模型是人源化的NSG-SGM3小鼠,这个小鼠是一个基于NSG背景的转基因动物,其中S代表人的干细胞因子,其主要发挥的作用是促进干细胞的自我更新,加快干细胞重建速度;GM代表GM-CSF(粒细胞和巨噬细胞集落刺激因子)和人的3代表IL3,这两个细胞因子的主要作用是刺激干细胞向髓系免疫细胞分化和发育。因此,和普通的NSG小鼠不同,该小鼠重建后,除了人源的TB细胞以外,人的单核细胞也会有较高水平的重建。

同时,在该动物中,人源的T细胞主要是在小鼠胸腺中进行分化和发育,因此不会对小鼠自身的抗原产生免疫反应,所以和人源的PBMC相比,该动物模型中分离的人源T细胞重新移植进SGM3小鼠中,并不会产生GVHD反应。那么,从小鼠胸腺中发育得到的T细胞是否同样具备功能呢?
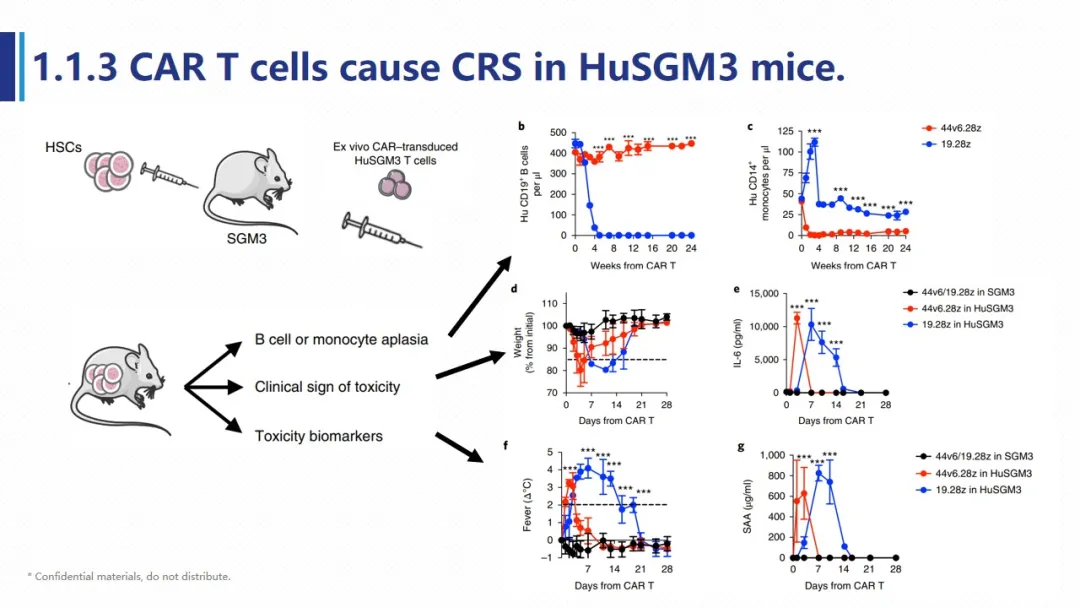
作者分别将自体和异体的DC细胞重新注射到人源化SGM3小鼠中后发现,人源化小鼠体内的T细胞仅对异体的DC细胞产生T细胞混合淋巴反应。所以随后作者利用人源化小鼠的以上特点,分离动物体内T细胞构建CAR-T并输注至同批次其他小鼠中进行药效及Biomarker的检测,来模拟临床患者CAR-T的构建及自体回输过程。文章利用小鼠自体重建的人源T细胞构建了靶向CD19及CD44的CART,这些CART回输后可有效地清除小鼠自体的B细胞和单核细胞,并引起体重下降,体温升高,IL-6及SAA(CRP) 释放等CRS相关症状。
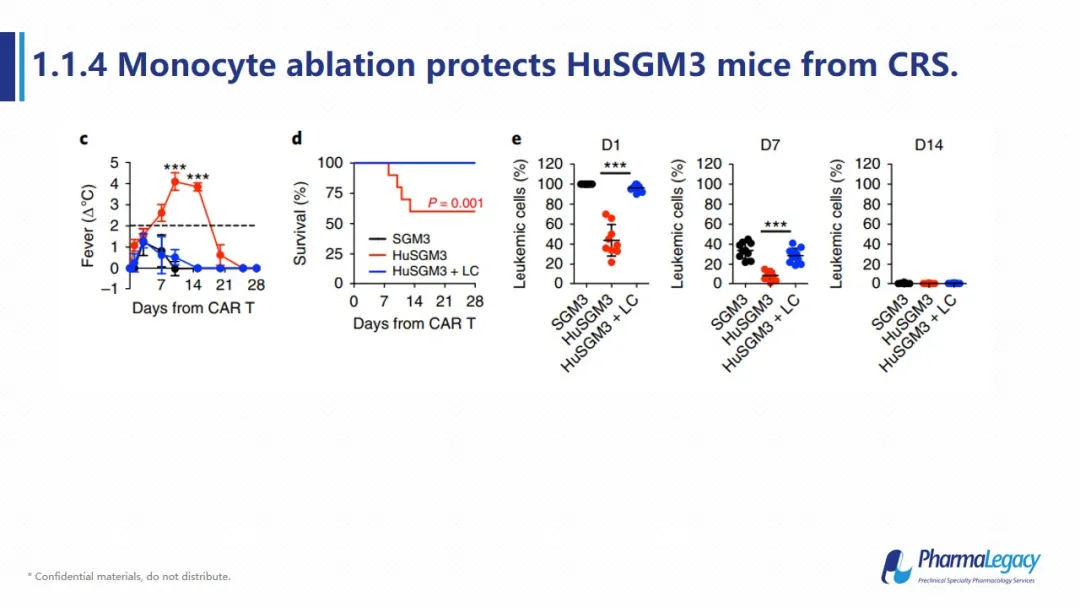
在临床实验中,单核细胞所分泌的细胞因子是CRS的主要来源,在人源化小鼠中是否同样可以证实这一点呢?当对人源化动物使用单核细胞清除剂后,再次给予CD19 CART细胞,和没有进行单核细胞清除的动物相比,动物发烧等CRS症状明显减轻、死亡率下降,但是与此同时,CAR-T对肿瘤细胞的清除速率也一同下降。
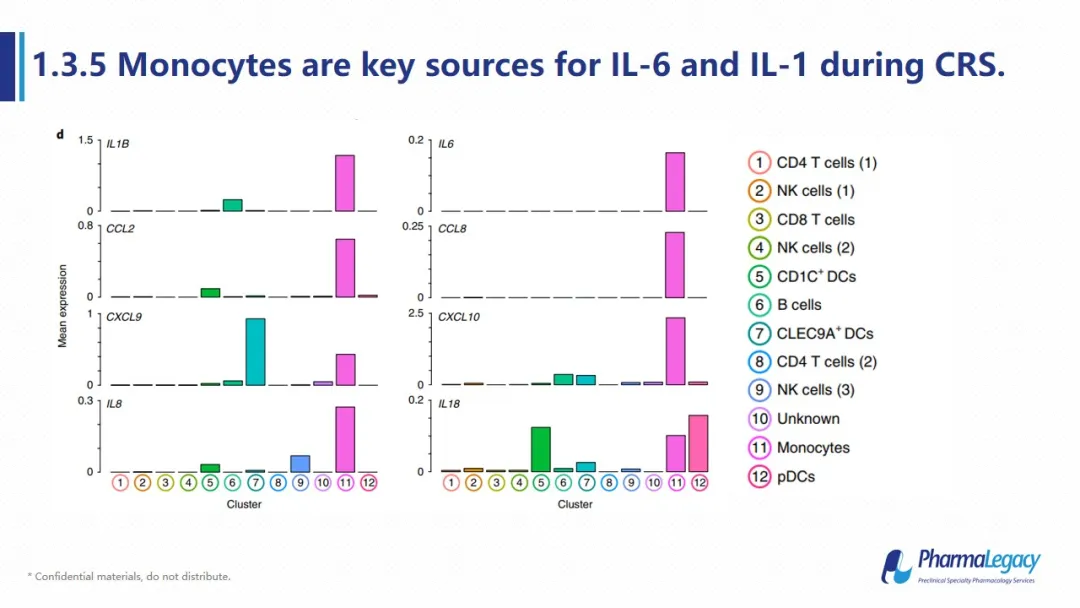
对该动物所有免疫细胞进行单细胞测序表明,在CAR-T的治疗中,单核细胞是主要的细胞因子贡献者,与临床上观察到的情况一致。
这篇文章给我们的启示是,常规,我们利用免疫缺陷动物进行CAR-T的临床前药效评价得到的结论是非常片面的,人源单核细胞的存在无论对CAR-T的安全性还是有效性来说,都是非常必要的。

第二篇文章主要讨论的是:人的髓系免疫细胞会对,慢病毒在体转染CAR-T的转染效率及药效产生重要的影响。
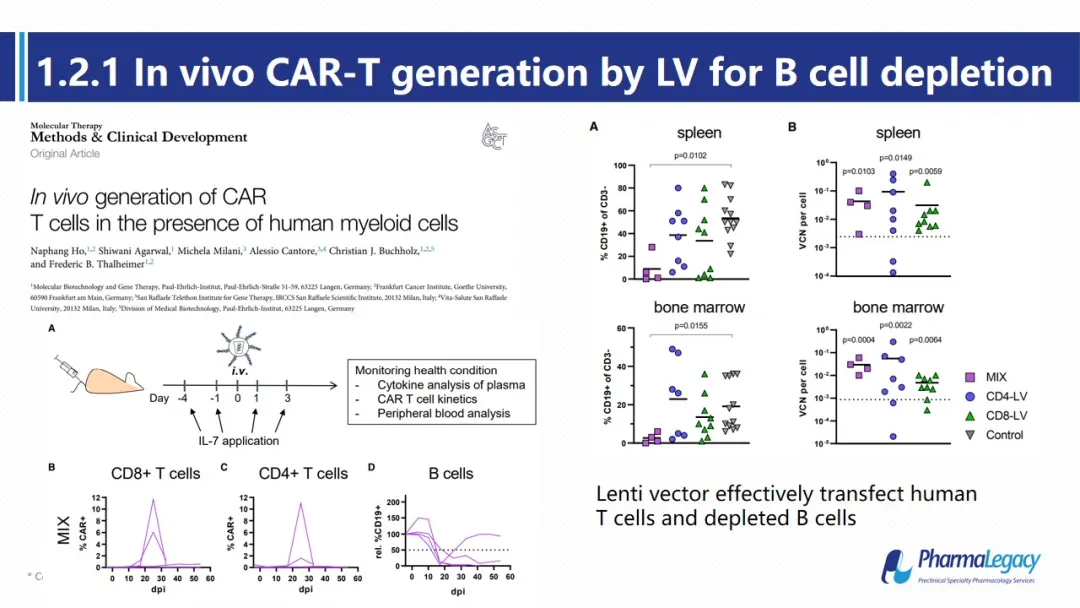
本实验在人源化小鼠中,通过靶向CD4及CD8 T细胞的病毒载体,进行在体CD19 CAR-T转染,该病毒成功转染T细胞并发挥了对自体B细胞清除作用。其外周血,脾脏及骨髓中的B细胞比例均明显降低。
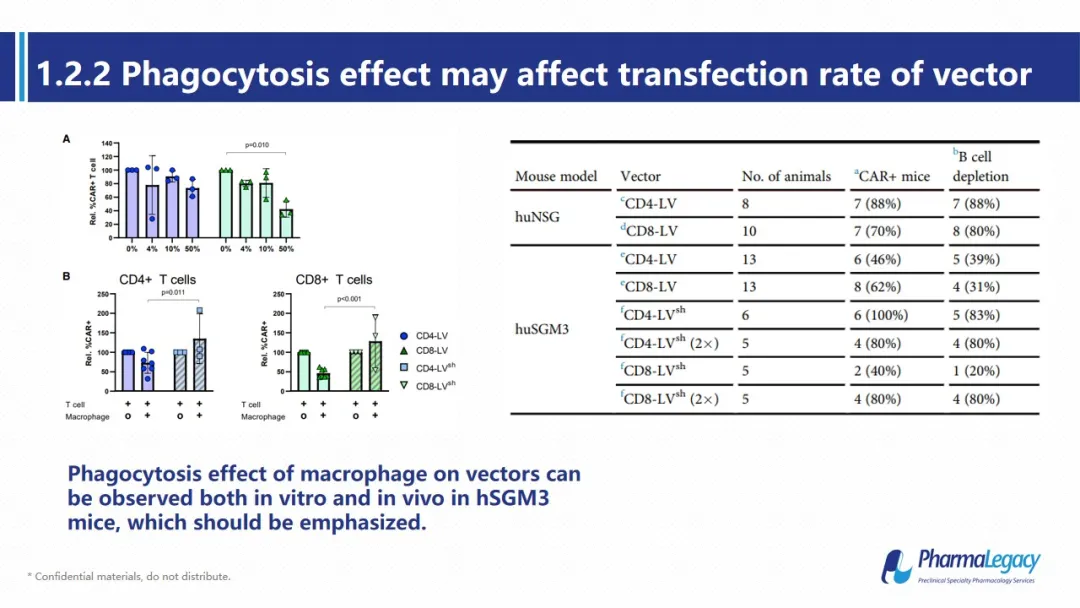
但是在转染系统中有单核细胞存在的情况下,无论体外还是体内的转染效率均会出现一定程度的降低,且随着单核细胞的占比提升,转染效率呈剂量依赖性的下降。在存在单核细胞的人源化SGM3小鼠中,相比于普通的人源化NSG小鼠,两种病毒其体内的转染效率均更低,对B细胞的清除能力也相应降低。
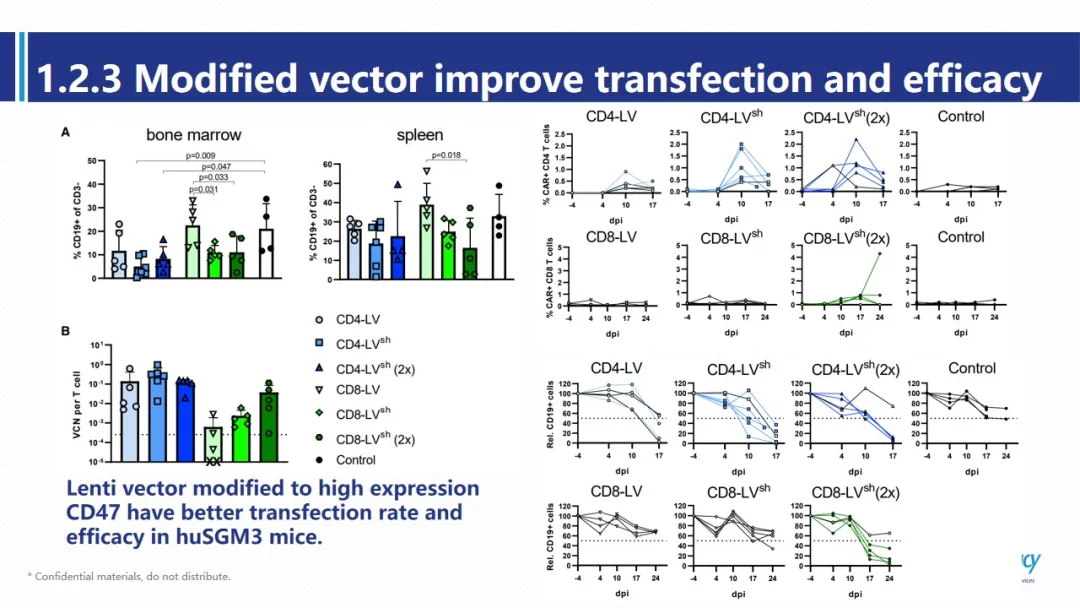
这一现象提示我们,单核/巨噬细胞可能会对慢病毒载体产生吞噬作用进而影响转染效率。为了证明这一假设,作者对慢病毒进行修饰,使其表达CD47分子,高表达CD47分子的病毒颗粒可以有效减少人源单核/巨噬细胞对载体的吞噬作用。转染效率比未经修饰的载体提高超过一倍,对B细胞的清除能力也相应上升。这两篇文章告诉我们,常规在免疫缺陷动物中得到的CAR-T相关的临床前数据是不够准确的。当我们选择使用更接近人体真实环境的动物模型时,我们会得到更多且更为准确的信息,尤其是当环境中缺少髓系免疫细胞时,CAR-T的药效及其产生的副作用都是会被低估的;在体病毒转染的效率往往又是被高估的。
接下来的一个例子是人源化动物在基因治疗SCD中的应用。
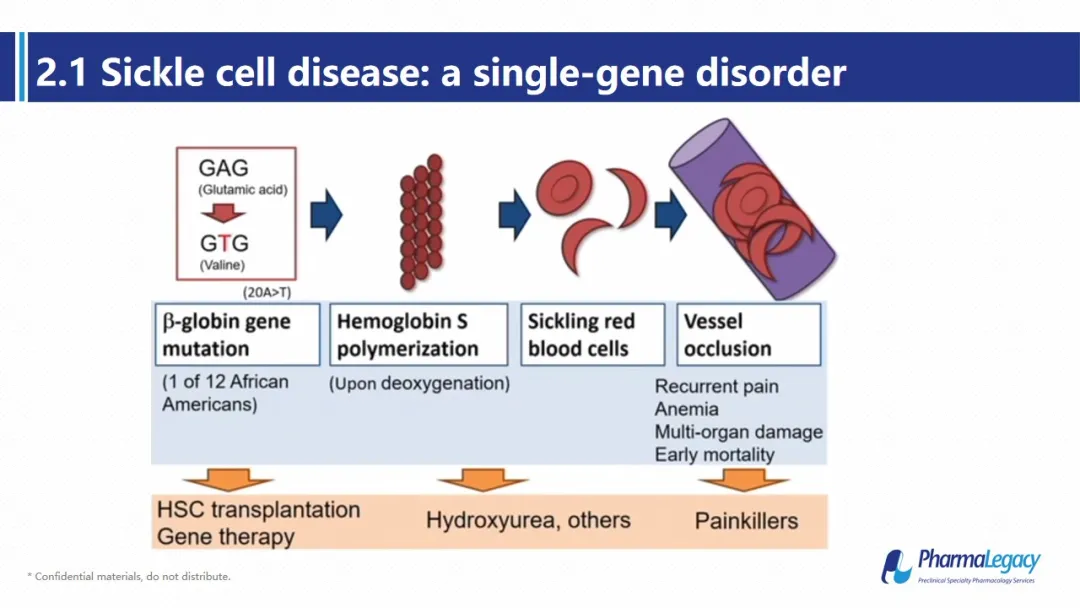
镰状细胞病是世界上最常见的单基因疾病。它是由b-珠蛋白的单碱基突变引起谷氨酸被缬氨酸所代替,构成镰状血红蛋白,进而造成红细胞外形出现镰刀样改变,进而引起血细胞破裂、贫血、反复疼痛、器官损伤和早期死亡。目前临床上暂无有效手段,主要采取对症治疗,例如输血和疼痛管理等。
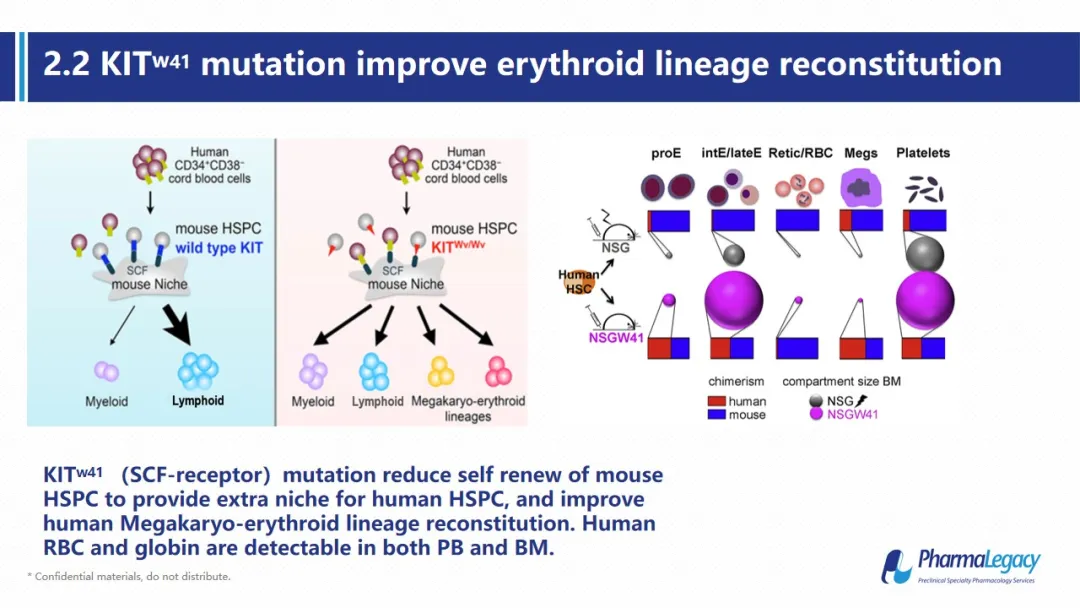
本研究中使用的动物模型为人源化的NSGW41小鼠。NSGW41是在普通NSG动物的基础上引入了KIT基因的W41突变, KIT基因也被称为SCF受体基因,该基因突变后,小鼠的干细胞与SCF亲和力下降,使其自身干细胞的增殖与更新受到影响。从而为人源干细胞的发育提供的供更多的生态位,更有利于人源红细胞系的重建。
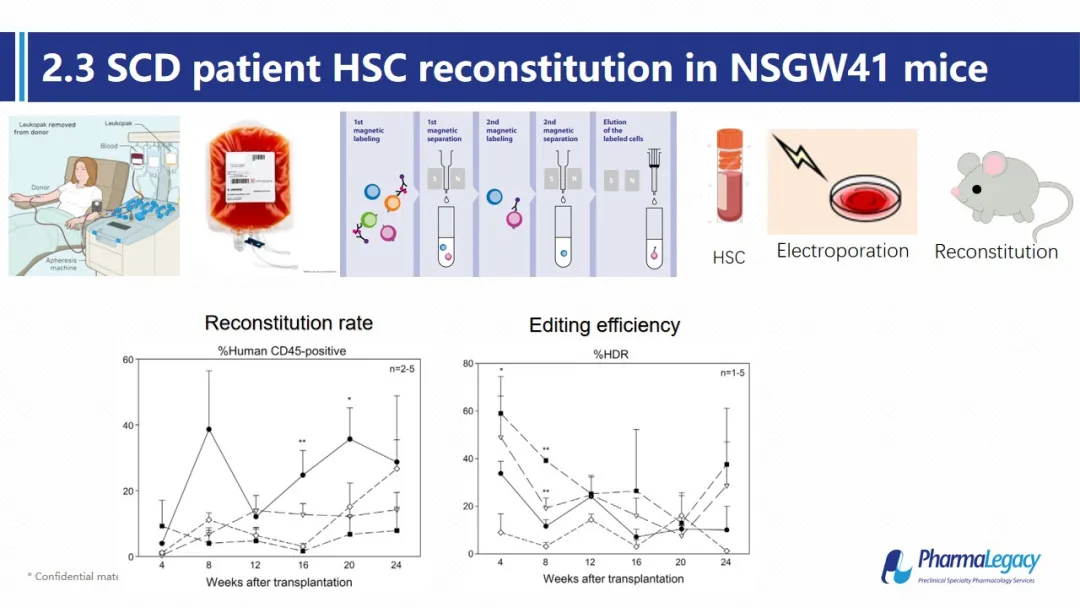
在这篇文章中,作者使用CRISPR-CAS9 的技术将病人造血干细胞中的突变基因修复,随后将修复后的造血干细胞移植到带有Kit W41突变的NSG小鼠中,对其修复后的造血干细胞重建情况及修复后的血红蛋白在血液中的含量进行观察以评估治疗效果。可见在移植后的人源化小鼠中,虽然定植的干细胞中正常基因型的只有40%,但是外周最多可以有60%左右的血红蛋白为修复后的正常蛋白。并可维持在20%左右至少24周。
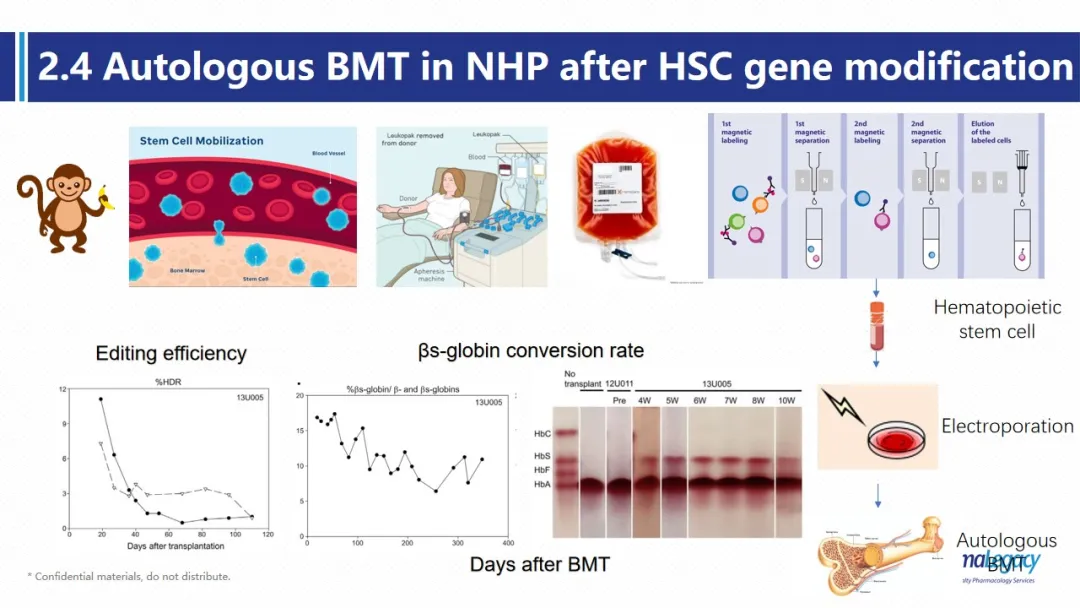
由于没有办法找到疾病猴,该文章作者对猴子的HSC进行反向编辑,将其基因更改为镰刀型红细胞贫血症所携带的单基因突变。经自体骨髓移植后,外周血中经过基因的干细胞约占大约20%,其外周最多可以有100%的血红蛋白为经过编辑的蛋白,并可维持在5-10%的水平至少300天。可见虽然两个模型均可用于造血干细胞基因编辑效率及重建的评估模型,但食蟹猴中经过编辑的造血干细胞及血红蛋白的存续性不及人源化小鼠模型。造成该问题的可能原因包括小鼠的重度免疫缺陷更容易被干细胞定植,及食蟹猴经过编辑的SCD干细胞的增殖能力及患病红细胞本身就更易受损破裂,进一步影响了其存续性。在药物研究中,基于特定通路或靶点的模式化的疾病模型应用已经非常广泛。但这类疾病模型在降低模型的复杂性,提高药物研发效率的同时,可能忽略了疾病的复杂性,常常无法完全重现复杂的临床症状。因此,相对复杂但与临床更为贴近的疾病模型,更有可能真正提高药物的研发效率,帮助大家更好的理解药物的作用机制,并为临床试验阶段提供更多的有效信息,并提高临床转化率。